-
下列食品添加剂中,其使用目的与反应速率有关的是
A. 抗氧化剂 B. 调味剂 C. 着色剂 D. 增稠剂
难度: 简单查看答案及解析
-
下列不属于新能源开发利用的是( )
A. 太阳能热水器
 B. 天然气动力汽车
B. 天然气动力汽车
C. 潮汐能发电
 D. 风能发电
D. 风能发电
难度: 简单查看答案及解析
-
2017年8月,四川九寨沟地震造成了重大人员财产损失。地震救援中需要使用大量的消毒剂,下列消毒剂属于强电解质的是( )
A. 次氯酸 B. 二氧化氯 C. 酒精 D. 高锰酸钾
难度: 中等查看答案及解析
-
向饱和石灰水中投入0.56g氧化钙,并恢复到原来的温度,下列说法正确的是( )
A. 溶液的pH增大 B. 溶液中c(Ca2+)不变
C. OH-数目不变 D. 析出的Ca(OH)2质量为0.74g
难度: 中等查看答案及解析
-
与纯水的电离相似,液氨中也存在着微弱的电离:2NH3⇌NH4++NH2﹣,据此判断以下叙述中不正确的是( )
A. 液氨中含有NH3、NH4+、NH2﹣微粒
B. 其他条件不变,若增加液氨的量,电离平衡将正向移动
C. 只要不加入其他物质,液氨中c(NH4+)=c(NH2﹣)
D. 一定温度下液氨中c(NH4+)• c(NH2﹣)是一个常数
难度: 中等查看答案及解析
-
已知热化学方程式:2H2(g)+O2(g) =2H2O(l) ∆H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(l) ∆H= -1452 kJ·mol-1,H+(aq)+OH-(aq) =H2O(l) ∆H= -57.3 kJ·mol-1。据此判断下列说法正确的是
A. CH3OH的燃烧热∆H为-1452 kJ·mol-1
B. 2H2(g)+O2(g) =2H2O(g) ∆H > -571.6 kJ·mol-1
C. CH3COOH(aq)+NaOH(aq)=H2O(l)+CH3COONa(aq) ∆H= -57.3 kJ·mol-1
D. 2CH3OH(l)+O2(g)=2CO2(g)+4H2(g) ∆H= -880.4 kJ·mol-1
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中一定大量共存的是( )
A. 含有AlO2-的溶液中:Na+ 、Al3+、Cl-、K+
B. 常温下由水电离出的c(H+)·c(OH-)=10-20 mol2·L-2的溶液中:Na+、NH
、Cl-
C. 常温下 c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
D. 在c(H+)=1.0×10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-
难度: 中等查看答案及解析
-
下列说法与盐类水解有关且正确的是: ( )
A. AlCl3溶液和NaAlO2溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C. 用加热的方法可除去KCl溶液中混有的Fe3+
D. 食醋可以溶解水垢
难度: 简单查看答案及解析
-
在室温下,下列叙述正确的是
A. 将1mL1.0×10-5mol/L盐酸稀释到1000mL,溶液的pH=8
B. 用pH=1的盐酸分别中和1mL pH=13的NaOH溶液和氨水,NaOH消耗盐酸的体积大
C. pH=2的盐酸与pH=1的硫酸比较,c(Cl-)=c(SO42-)
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中c(Cl-)/c(Br-)不变
难度: 中等查看答案及解析
-
在一个体积恒定的密闭容器中,加入2molA和1molB发生反应:2A(g)+B(g)⇌3C(g)+D(g),一定条件下达到平衡时,C的浓度为Wmol•L-1,若容器体积和温度保持不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为Wmol•L-1的是( )
A. 4molA+2molB B. 3molC+1molD
C. 2molA+1molB+3molC+1molD D. 1molA+0.5molB+3molC+1molD
难度: 中等查看答案及解析
-
2NO2(红棕色)
N2O4(无色) ΔH<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )
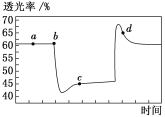
A. b点达到了平衡状态
B. b点对应的时刻改变的条件是将注射器的活塞向外拉
C. d点:v(正)<v(逆)
D. 若在c点将温度降低,其透光率将增大
难度: 困难查看答案及解析
-
下列说法正确的是
A. 某温度时,1LpH = 6的水溶液,含1.0×10-6molOH-离子
B. 含10.6g Na2CO3溶液中,所含阴离子总数等于0.1mol
C. 用TiCl4制备TiO2:TiCl4 +(x+2) H2O(过量)= TiO2·xH2O↓+ 4HCl
D. 用弱酸溶液滴定强碱溶液时可用甲基橙作指示剂
难度: 简单查看答案及解析
-
在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
难度: 困难查看答案及解析
-
下列说法中不正确的是( )
弱酸
CH3COOH
HClO
H2CO3
电离平衡常数
( 25℃)
Ki=1.76×10﹣5
Ki=2.95×10﹣8
Ki1=4.30×10﹣7
Ki2=5.60×10﹣11
A. pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液中c(Na+):③<②<①
B. 一定浓度的NaHS溶液中:c(Na+)+ c(H+) = c(OH-) +c(HS-)+2c(S2-)
C. pH=a的氨水,稀释至原体积的10倍后, 其pH=b, 则b>a-1
D. 室温下,甲、乙两烧杯均盛有5mL pH=2的某一元酸溶液,向乙烧杯中加水稀释至pH=3,则甲乙两个烧杯中,由水电离出来的c(OH—):10c(OH-)甲≤c(OH-)乙
难度: 中等查看答案及解析
-
对下列图像描述正确的是
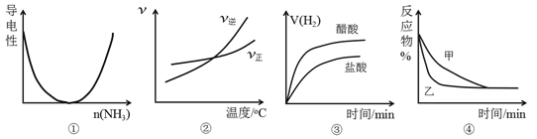
A. 图①可表示将氨气通入醋酸溶液至过量过程中溶液导电性的变化
B. 根据图②可判断可逆反应A2(g)+3B2(g)
2AB3(g)的ΔH>0
C. 图③表示等体积、等pH的盐酸与醋酸溶液分别与足量的锌粉发生反应产生氢气的体积(V)随时的变化的示意图
D. 图④可表示压强对可逆反应A(g)+B(g)
2C(g)+D(g)的影响,乙的压强大
难度: 困难查看答案及解析
-
已知Ksp(CaCO3)=2.8×10﹣9,下列判断正确的是( )
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32﹣+2H2O⇌H2CO3+2OH﹣
B. 常温时,pH = 3的盐酸和pH = 11的氨水等体积混合后所得溶液中,c(H+ )>c(OH—)
C. NaHCO3溶液中:c(OH﹣)﹣c(H+)=c(H2CO3)﹣c(CO32﹣)
D. 2×10﹣4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10﹣5 mol/L
难度: 中等查看答案及解析
-
已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大。I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I3-(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )
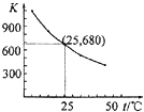
A. 反应I2(aq)+I-(aq)
I3 -(aq)的ΔH>0
B. 利用该反应可以除去硫粉中少量的碘单质
C. 在上述平衡体系中加入CCl4,平衡不移动
D. 25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
难度: 中等查看答案及解析
-
室温时,CH3COOH的电离平衡常数为K,向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是( )
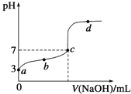
A. b点表示的溶液中c(Na+)>c(CH3COO﹣)
B. c点表示CH3COOH和NaOH恰好反应完全
C. d点表示的溶液中c(CH3COO﹣) c(H+)/c(CH3COOH)大于K
D. b、c、d三点表示的溶液中一定都存在:c(Na+)+c(H+)═c(CH3COO﹣)+c(OH﹣)
难度: 中等查看答案及解析
-
在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应:2A(g)+B(g)
2C(g)ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是( )
A. 若反应开始时容器体积为2L,则Vc=0.4mol•L-1•min-1
B. 若在恒压绝热条件下反应,平衡后nc<1.6mol
C. 若2min后,向容器中再投入2mol A和1 mol B, B的转化率变大
D. 若该反应在恒温恒容下进行,放出热量将增加
难度: 中等查看答案及解析
-
下列说法关于离子浓度说法不正确的是
A. 室温下,向0.20 mol/L NH4HCO3中通入CO2至溶液呈中性:c(NH4+)=c(HCO3—)+2c(CO32—)
B. 10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,c(Cl-)>c(NH4+)>c ( OHˉ)>c (H+)
C. 向0.30mol/L Na2SO3中通入CO2:c(Na+)=2[c(SO32—)+c(HSO3—)+c(H2SO3)]
D. 10mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c (Cl﹣)>c(OH-)>c(H+)
难度: 中等查看答案及解析