-
下列现象与电化学腐蚀无关的是
A. 黄铜(铜锌合金)制作的铜锣不易产生铜绿
B. 生铁比纯铁容易生锈
C. 铁质器件附有铜质配件在接触处易生锈
D. 银制奖牌久置后表面变暗
难度: 中等查看答案及解析
-
研究有机物一般经过以下几个基本步骤:分离提纯→确定实验式→确定分子式→确定结构式。以下用于研究有机物的方法错误的是( )
A. 蒸馏常用于分离提纯液态有机混合物
B. 燃烧法是研究确定有机物成分的有效方法
C. 核磁共振氢谱通常用于分析有机物的相对分子质量
D. 对有机物分子红外光谱图的研究有助于确定有机物分子中的基团
难度: 中等查看答案及解析
-
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )
A. 该反应中,热能转化为产物内部的能量
B. NH4HCO3和盐酸的反应是放热反应
C. 反应物的总能量高于生成物的总能量
D. 反应的热化学方程式为:NH4HCO3 + HCl = NH4Cl+CO2↑+H2O △H>0
难度: 中等查看答案及解析
-
下列事实中,能说明HNO2是弱电解质的是
A. 用HNO2溶液做导电性实验,灯泡较暗
B. HNO2是共价化合物
C. HNO2溶液不与NaCl反应
D. 室温下,0.1mol·L-1HNO2溶液的pH为2.15
难度: 中等查看答案及解析
-
为了除去氯化镁酸性溶液中的Fe3+,可以在加热搅拌的条件下加入一种过量的试剂,过滤后再加入适量的盐酸。这种试剂是( )
A. 氨水 B. 氢氧化钠 C. 碳酸钠 D. 碳酸镁
难度: 中等查看答案及解析
-
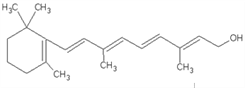
某有机物的结构简式如下,此有机化合物属于( )
①烯烃 ②多官能团有机化合物 ③芳香化合物 ④ 烃的衍生物 ⑤高分子化合物
A. ①②③④ B. ② ④ C. ② ③ ④ D. ① ③ ⑤
难度: 中等查看答案及解析
-
食品保鲜所用的“双吸剂”,是由还原铁粉、生石灰、氯化钠、炭粉等按一定比例组成的混合物,可吸收氧气和水。下列分析不正确的是( )
A. “双吸剂”中的生石灰有吸水作用 B. “双吸剂”吸收氧气时,发生了原电池反应
C. 炭粉上发生的反应为:O2+4e- +H+ =2H2O D. 吸收氧气的过程中,铁作原电池的负极
难度: 中等查看答案及解析
-
结合图判断,下列叙述正确的是
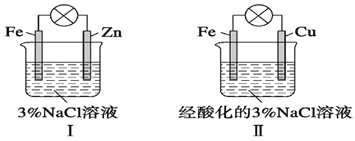
A. Ⅰ和Ⅱ中正极均被保护
B. Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C. Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D. Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
难度: 中等查看答案及解析
-
下列各组混合物总物质的量均为a mol,当每组物质以任意物质的量之比混合完全燃烧时,消耗O2的量不变的是( )
A. 甲烷、甲醇 B. 乙醇、乙烯 C. 乙烯、环丙烷 D. 乙炔、苯
难度: 中等查看答案及解析
-
下列除去杂质的方法准确的是( )
A. 除去乙烷中少量的乙烯:光照的条件下通入氯气 ,气液分离
B. 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液
C. 除去乙烷中少量的乙烯:气体通过盛有酸性高锰酸钾溶液的洗气瓶
D. 除去乙醇中少量的乙酸:加入氢氧化钠溶液、分液
难度: 中等查看答案及解析
-
某物质在质谱仪中的最大质荷比为62,该物质的核磁共振氢谱吸收峰共有2组,红外吸收峰表明有O—H键和C—H建。该物质是( )
A. CH3COOH B. HOCH2CH2OH C. CH3OCH2OH D. CH3OCH3
难度: 简单查看答案及解析
-
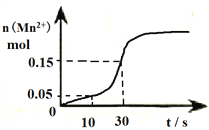
在密闭容器中的一定量混合气体发生反应:x A(g) + yB(g)
z C(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是( )
A. x+y>z B. 平衡向正反应方向移动 C. B的转化率升高 D. C的体积分数增大
难度: 中等查看答案及解析
-
某烃和H2加成后得到2,2—二甲基丁烷,该烃的名称可能是( )
① 2,2—二甲基—1—丁烯 ② 3,3—二甲基—1—丁烯 ③ 3,3—二甲基—1—丁炔 ④ 2,3—二甲基—1,3—丁二烯
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析
-
太阳能电池板面对太阳时,一部分电能直接供给“天宫一号”,一部分电能则储存在电池里,供背离太阳时使用。“天宫一号”使用的是镍氢电池,电解质溶液显碱性。其反应方程式为: LaNi5+Ni(OH)2
LaNi5H+NiOOH。下列有关说法不正确的是
A.放电时镍被还原 B.放电时负极LaNi5H+OH——e—=LaNi5+H2O
C.充电时OH—向阴极移动 D.充电时每消耗lmol Ni(OH)2转移lmol电子
难度: 中等查看答案及解析
-
下列有关说法中,不正确的是( )
A. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,使用催化剂可以加快该反应的速率.
B. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
C. 室温下,pH=4的NaHSO4溶液中,水电离出的H+浓度为1×10-10 mol/L
D. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
难度: 中等查看答案及解析
-
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)其归纳正确的是( )
①反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2∶1。
③pH相等的三种溶液:a.CH3COONa b.NaHCO3 c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④常温下,pH=1的强酸溶液,加水稀释后,溶液中所有离子浓度均降低。
⑤在等物质的量浓度、等体积的氯化铵和氨水的混合溶液中存在下列关系:c(NH4+)+2c(H+)=2c(OH-)+c(NH3·H2O)
⑥反应A(g)
2B(g)△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则 △H =(Ea -Eb)kJ·mol-1。
A. 全部 B. ②④⑤⑥ C. ①③④⑥ D. ①③⑤⑥
难度: 中等查看答案及解析
-
在温度相同、容积均为2L的三个恒容密闭容器中,按不同方式投入反应物,发生反应:N2(g)+3H2(g)
2NH3(g)△H= -92.4kJ/mol;保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是( )
容器
甲
乙
丙
反应物投入量
1molN2、3molH2
2molN2、6molH2
2molNH3
NH3 的浓度(mol/L)
c1
c2
c3
反应的能量变化
放出Q1kJ
放出Q2kJ
吸收Q3kJ
体系压强
p1
p2
p3
反应物转化率
A. 2p1=2p3<p2 B. 达到平衡时丙容器中NH3的体积分数最大
C. Q3+92.4
=92.4 D.
<1
难度: 困难查看答案及解析
-
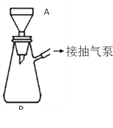
工业上电解法处理含镍酸性废水并得到单质Ni的原理如右图所示。下列说法不正确的是( )

已知: ①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应: 4OH— — 4e— = O2↑+2H2O
B. 为了提高Ni的产率,电解过程中需要控制废水pH
C. 电解过程中,B中NaCl溶液的物质的量浓度将不断减小
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
难度: 中等查看答案及解析
-
分子式为C10H14的二取代芳烃(即苯环上有两个侧链),其可能的结构有( )
A. 6 B. 9 C. 15 D. 22
难度: 中等查看答案及解析
-
一定温度下,下列溶液中各微粒的物质的量浓度关系正确的是( )
A. 0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
B. 相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③
C. 0.2mol/L的NaHCO3溶液与0.3 mol/L的Ba(OH)2溶液等体积混合,所得溶液中:c(OH-)>c(Ba2+)>c(Na+)>c(H+)
D. 等物质的量的NaClO、NaHCO3混合溶液中:c(HClO) + c(ClO-) = c(HCO3-) + c(H2CO3)+c(CO32-)
难度: 困难查看答案及解析