-
已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大,A基态原子中,电子占据的最高能层符号为L,其核外有两对成对电子,激发态最多有4个成单电子,C的基态原子中电子占据的最高能层符号也为L,p能级上有4个电子;D原子的最外层电子数与电子层数之积等于A、B、C三种元素的原子序数之和,E原子核外电子总数比铁原子多两个,F基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)基态F核外电子排布式为______________________。
(2)基态E原子的价电子排布式为______________________。
(3)DC4-的空间构型是___________,与DC4-互为等电子体的一种分子为___________(填化学式);HBC3酸性比HBC2强,其原因是______________________。
(4)A、B、C三种元素第一电离能最大的是___________(用元素符号表示),其原因是_________________________________。
(5)向E(NO3)2溶液中逐滴加入氨水,刚开始时生成绿色的E(OH)3沉淀,当氨水过量时,沉淀会溶解,生成[E(NH3)6]2+的蓝色溶液,则1mol[E(NH3)6]2+含有的σ键数目为___________。
(6)D、Na形成的一种离子化合物,在如图所示晶胞结构图中黑球表示Na的位置,白球表示D的位置,已知该晶胞的边长为ncm,阿伏加德罗常数为NA,晶胞的密度ρ=___________g/cm3(用含n、NA的计算式表示)。
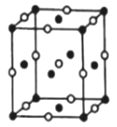
-
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均己充满电子。请回答下列问题:
(1) Z2+基态核外电子排布式为______________。
(2) YX4-的空间构型是______________,与YX4-互为等电子体的一种分子为_____________(填化学式);HYX4酸性比HYX2强,其原因是_____________。
(3)结构简式为RX (W2H3)2的化合物中R原子的杂化轨道类型为_____________;lmo1RX (W2H3) 2分子中含有σ键数目为_____________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_____________。
A. [Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.在[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。
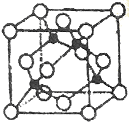
①该晶体的化学式为_____________
②已知Z和Y的电负性分别为1.9和3.0,则Y与L形成的化合物属于_____________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为_____________pm(只写计算式)。
-
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均己充满电子。请回答下列问题:
(1) Z2+基态核外电子排布式为______________。
(2) YX4-的空间构型是______________,与YX4-互为等电子体的一种分子为_____________(填化学式);HYX4酸性比HYX2强,其原因是_____________。
(3)结构简式为RX (W2H3)2的化合物中R原子的杂化轨道类型为_____________;lmo1RX (W2H3)2分子中含有σ键数目为_____________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_____________。
A. [Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.在[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。
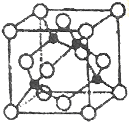
①该晶体的化学式为_____________
②已知Z和Y的电负性分别为1.9和3.0,则Y与L形成的化合物属于_____________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为_____________pm(只写计算式)。
-
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均己充满电子。请回答下列问题:
(1) Z2+基态核外电子排布式为______________。
(2) YX4-的空间构型是______________,与YX4-互为等电子体的一种分子为_____________(填化学式);HYX4酸性比HYX2强,其原因是_____________。
(3)结构简式为RX (W2H3)2的化合物中R原子的杂化轨道类型为_____________;lmo1RX (W2H3)2分子中含有σ键数目为_____________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_____________。
A. [Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.在[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。
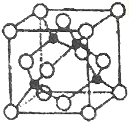
①该晶体的化学式为_____________
②已知Z和Y的电负性分别为1.9和3.0,则Y与L形成的化合物属于_____________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为_____________pm(只写计算式)。
-
【化学——选修3:物质结构与性质】周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z2+基态核外电子排布式为:_______________________。
(2)YX4-的空间构型是:_________,HYX4酸性比HYX2强,其原因是:_______________。
(3)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为:________________ (H为氢元素,下同)
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是:____________。A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道进
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如下图所示 (黑点代表Z原子)。
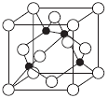
①该晶体的化学式为____________。
②已知该晶体的密度为ρg·cm-3,阿伏加徳罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为___________㎝(只写计算式)(Z原子位于体对角线上)。
-
【化学—选修3 物质结构与性质】
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z2+基态核外电子排布式为________________。
(2)YX4-的空间构型是_______;与YX4-互为等电子体的一种分子为_______(填化学式);HYX4酸性比HYX2强,其原因是____________________。
(3)结构简式为RX(W2H3)2的化合物中R原子的杂化轨道类型为_______;1molRX(W2H3)2分子中含有σ键数目为_______________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_______。
A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。
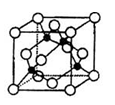
①该晶体的化学式为 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于 (填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为 pm(只写计算式)。
-
【化学—选修3 物质结构与性质】
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z2+基态核外电子排布式为: 。
(2)YX4-的空间构型是:__________;与YX4-互为等电子体的一种分子为__________(填化学式);HYX4酸性比HYX2强,其原因是:__________________________。
(3)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为: ;1molRX(WH2)2分子中含有σ键数目为:_______________。(H为氢元素,下同)
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是:__________。
A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如右图所示(黑点代表Z原子)。
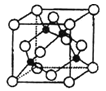
①该晶体的化学式为: 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于 (填“离子”、“共价”)化合物。
③ 已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为: cm(只写计算式)(Z原子位于体对角线上)。
-
【化学—选修3 物质结构与性质】
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z2+基态核外电子排布式为: 。
(2)YX4-的空间构型是:__________;与YX4-互为等电子体的一种分子为__________(填化学式);HYX4酸性比HYX2强,其原因是:__________________________。
(3)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为: ;1molRX(WH2)2分子中含有σ键数目为:_______________。(H为氢元素,下同)
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是:__________。
A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如右图所示(黑点代表Z原子)。
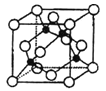
①该晶体的化学式为: 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于 (填“离子”、“共价”)化合物。
③ 已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为: cm(只写计算式)(Z原子位于体对角线上)。
-
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同;基态b原子的核外电子占据3个能级,且最高能级轨道为半充满状态;c的最外层电子数是内层电子数的3倍;d的原子序数是c的两倍;基态e原子3d轨道上有4个单电子。
回答下列问题:
(1)b、c、d电负性最大的是___(填元素符号)。
(2)b单质分子中σ键与π键的个数比为___。
(3)a与c可形成两种二元化合物分子,两种物质可以任意比互溶。其中一种不稳定,可分解产生c的单质,该化合物分子中的c原子的杂化方式为___;这两种物质的互溶物中,存在的化学键有___(填序号)。
①极性共价键 ②非极性共价键 ③离子键 ④金属键 ⑤氢键 ⑥范德华力
(4)这些元素形成的含氧酸中,分子内中心原子的价层电子对数为4的酸是___(填化学式,下同);酸根呈正三角形结构的酸是___,试从两者结构特点判断该酸分子与酸根离子的稳定性:酸分子___酸根离子(填“>”或“<”)。
(5)元素e在周期表中的位置是___区;e的一种常见氯化物中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在,结构式为 ,请补写e的元素符号并用“→”表示出其中的配位键___。
,请补写e的元素符号并用“→”表示出其中的配位键___。
-
前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的核外电子排布式为______;基态D原子核外电子占据的能量最高的能级符号为_____________。
(2)A元素的各级电离能如下:
| 能级(I) | I1 | I2 | I3 | I4 | I5 |
| 电离能/kJ·mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
分析上表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是__________。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是________。
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是_______(填分子式)。
(5)(DC)4为热色性固体,且有色温效应。低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。在淡黄色→橙黄色→深红色的转化中,破坏的作用力是____;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_______。在B、C、D的简单气态氢化物中,属于非极性分子的是______(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是_______________。
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示。已知:该晶体密度为ρg·㎝-3,NA代表阿伏伽德罗常数的值。

①该晶体的化学式为__________。
②在该晶体中,A与C形成共价键的键长(d)为_____pm。








