-
汽车尾气里含有 NO 气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)⇌2NO(g) ΔH>0,已知该反应在 240℃时,平衡常数 K=64×10-4。请回答:
(1)该温度下,向 2 L 的密闭容器中充入 N2 和 O2 各 1 mol,5分钟后O2的物质的量为 0.5 mol,则 用N2表示的反应速率为________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________ (填字母序号)。
A.消耗 1 mol N2 同时生成 1 mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(3)将 N2、O2 的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________ (填字母序号)。
A.  B.
B. 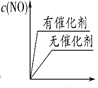 C.
C. 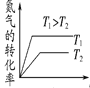
(4)该温度下,某时刻测得容器内 N2 、O2、NO 的浓度分别为 2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和 3.0×10-3mol·L-1,此时反应________ (填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是________
-
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g)  2NO(g) △H>0,已知该反应在某温度时,平衡常数K = 6.4×10-3。回答:
2NO(g) △H>0,已知该反应在某温度时,平衡常数K = 6.4×10-3。回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.6 mol,则N2的反应速率为_______________。
(2)假定该反应是在恒温、恒压条件下进行,判断该反应达到平衡的标志_______(填字母序号)。
A、混合气体密度不变
B、消耗1 mol N2同时消耗2 mol NO
C、混合气体平均相对分子质量不变
D、2υ正(N2) = υ逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势不正确的是_______(填字母序号)。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数______(填“变大”、“变小”或“不变”)。
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mo1/L、4.0×10-2 mo1/L和8.0×10-2 mo1/L,此时反应_____________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是____________________。
-
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g) ΔH>0。已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0。已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为___。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志___(填字母序号)。
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2v正(N2)=v逆(NO)
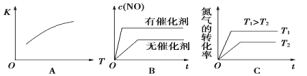
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是__(填字母序号)。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数_____(填“变大”“变小”或“不变”)。
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和3.0×10-3 mol·L-1,此时反应________________(填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是_______________________。
-
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g) ΔH>0。已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0。已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为___。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志___(填字母序号)。
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是__(填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数_____(填“变大”“变小”或“不变”)。
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和3.0×10-3 mol·L-1,此时反应________________(填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是_______________________。
-
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致: N2 (g) + O2 (g)  2NO(g) △H>0,已知该反应在240℃,平衡常数K=64×10-4,请回答:
2NO(g) △H>0,已知该反应在240℃,平衡常数K=64×10-4,请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率为______。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志______。
A.消耗1molN2同时生成1molO2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______(填字母序号)
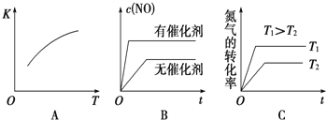
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态.与原平衡状态相比,此时平衡混合气中NO的体积分数______。(填“变大”、“变小”或“不变”)
(5)在240℃下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应______(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是_________________________________________。
-
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)  2NO(g) ΔH。请回答:
2NO(g) ΔH。请回答:
(1)已知:N2(g)+2O2(g)  2NO2(g) ΔH1 2NO2(g)
2NO2(g) ΔH1 2NO2(g)  O2+2NO(g) ΔH2
O2+2NO(g) ΔH2
ΔH=______________(用含ΔH1、ΔH2的表达式表示);
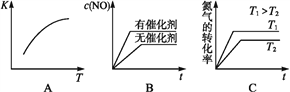
(2)下图是反应N2(g)+O2(g)  2NO(g)的“K-T”、“c(NO)-t”图,由图A可以推知该反应为_________反应(填“吸热”或“放热”)。由图B可知,与a对应的条件相比,b改变的条件可以是________;
2NO(g)的“K-T”、“c(NO)-t”图,由图A可以推知该反应为_________反应(填“吸热”或“放热”)。由图B可知,与a对应的条件相比,b改变的条件可以是________;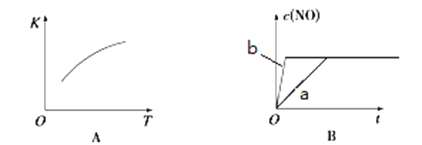
(3)已知反应在 T ℃时,平衡常数K=9.0,某时刻测得容器内N2、O2、NO的浓度分别为0.20 mol·L-1、0.20mol·L-1和0.50mol·L-1,此时反应N2(g)+O2(g)  2NO(g)_____________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
2NO(g)_____________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
(4)在一密闭容器中发生反应CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g),测得数据如下:
CaO(s)+SO2(g)+CO2(g),测得数据如下:

上述反应的平衡常数表达式为_______________,平衡时CO的转化率为_____________。
-
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g) 2NO(g),△H>0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
2NO(g),△H>0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率为______。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志______.
A.消耗1mol N2同时生成1mol O2  混合气体密度不变
混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______(填字母序号)。
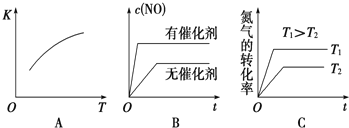
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态 与原平衡状态相比,此时平衡混合气中NO的体积分数______
与原平衡状态相比,此时平衡混合气中NO的体积分数______ 填“变大”、“变小”或“不变”
填“变大”、“变小”或“不变”
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应______(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是______。
-
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致: N2(g)+O2(g) 2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________。
A.消耗1 mol N2同时生成1 mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________(填字母序号)。
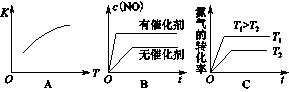
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数______。(填“变大、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应___________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是____
-
(10分)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g),ΔH>0,已知该反应在2 404℃,平衡常数K=64×10-4。请回答:
2NO(g),ΔH>0,已知该反应在2 404℃,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为_____________________。
(2)为了减少汽车尾气中有害气体的排放,在现实生活中你认为可以采取的措施有 。
A.采用耐高温的陶瓷发动机,以提高内燃机的工作温度
B.为了避免上述反应,不使用空气,改用纯氧气
C.在排气管中安装高效催化剂,将有害气体转化为无害气体
D.将燃油车改换成电动车
(3)将一定量的N2、O2的混合气体充入恒容密闭容器中,下图变化趋势正确的是____________(填字母序号)。

(4)将一定量的N2、O2的混合气体充入恒温密闭容器中,分别在不同的压强P1、P2(P1>P2)下达到平衡,请画出N2的转化率在不同压强下随时间变化的曲线图。(不同压强下的曲线要有相应的标识)
-
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)  2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则NO表示的反应速率_____________。
(2)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是_____________(填字母序号)。

(3)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数___________。(填“变大”、“变小”或“不变”)
(4)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是____________________。
B.
 C.
C. 










