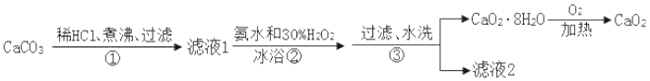
-
过氧化钙晶体(CaO2·8H2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
(1)过氧化钙晶体可用下列方法制备:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用如下制取装置制备过氧化钙晶体。
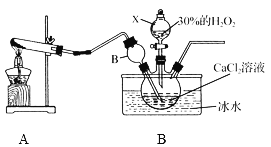
①装置A中发生反应的化学方程式为____________。
②装置C采用冰水浴控制温度在0 ℃左右,可能的原因主要有:
Ⅰ. 该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
Ⅱ.__________________________________。
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验晶体已洗涤干净的操作为:______。
(2)测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入2 mol·L-1的硫酸溶液,充分反应(I-被氧化I2)。
步骤二:向上述锥形瓶中加入几滴淀粉溶液以指示反应的终点。
步骤三:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出3次平均消耗Na2S2O3溶液体积为V mL。发生的反应为:I2+2S2O32-=2I-+S4O62-,产品中CaO2·8H2O的质量分数为____(用含字母的代数式表示)。
-
过氧化钙晶体﹝CaO2·8H2O﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒, 也在食品、牙膏、化妆品等制造中用作添加剂,还可以作为鱼池增氧剂。现以贝壳为原料制备CaO2流程如下:
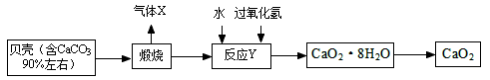
(1)将过氧化钙晶体与溶液分离的方法是_____。
(2)我国制碱工业的先驱侯德榜先生为纯碱和氮肥工业技术的发展做出了杰出的贡献。其制备 原料有气体 X、氨气、精制饱和食盐水,过程主要是先制得小苏打,再过滤并加热分解小苏打制得纯碱。
①实验过程中应该先向精制饱和食盐水中通入_____,其原因是_____。
②请写出制备纯碱第一步发生的化学方程式_____。
(3)反应Y 不能在较高温度下进行的原因是_____; 已知该反应是化合反应,则反应 Y 的化学方程式是___________________;获得的过氧化钙晶体中常含有 Ca(OH)2 杂质,原因是_________。
(4)现设计如下实验测定制得的过氧化钙晶体[CaO2·8H2O]中 CaO2 的质量分数:称取晶体样品25 g,加热到 220℃充分分解,其产物含有参与反应 Y 的固体物质和能使带火星木条复燃的气体等(此时所得气体混合物的总质量为1.6 g)(已知杂质不发生变化),则该晶体样品中 CaO2 的质量分数是_____。
-
过氧化钙晶体﹝CaO2·8H2O﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下:
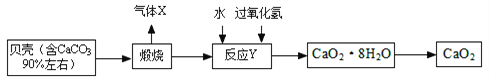
(1)气体X的名称是__________,实验室常用_____________溶液来吸收;将过氧化钙晶体与溶液分离的方法是________________。
(2)反应Y需控制温度在0~2℃,可将反应容器放在_________________中,该反应是化合反应,反应产物是CaO2·8H2O,请写出该反应的化学方程式_____________________________________。
(3)获得的过氧化钙晶体中常含有Ca(OH)2杂质,原因是___________________________。
-
过氧化钙是重要的无机过氧化物。近年来,这种产品的用途,伴随着应用技术的开发在迅速增多,现已广泛用于化学工业和农业等方面的生产。工业上生产过氧化钙的主要流程如下:



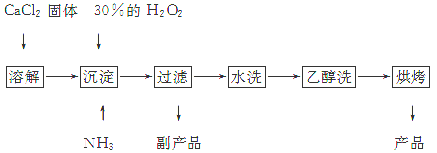
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是_________________________________;
(2)检验“水洗”是否合格的方法是__________________________________________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①_______________________________________________________________________;②_______________________________________________________________________。
-
(1)过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
①Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。Ca(OH)2+H2O2+6H2O=CaO2·8H2O,反应时通常加入过量的Ca(OH)2,其目的________________________________。
②向池塘水中加入一定量CaO2·8H2O后,池塘水中浓度增加的离子有________(填序号)。
A.Ca2+ B.H+ C.CO32- D.OH-
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。
A.KCl B.KClO3 C.MnO2 D.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是______________(用离子方程式说明)。
-
下列关于物质用途的叙述中不正确的是
A.纯碱可用于治疗胃酸过多的药剂
B.铝制容器可用于常温下贮存、运输浓硫酸
C.二氧化硅可用于制造光导纤维和石英坩埚
D.过氧化钠可用作漂白剂和呼吸面具中的供氧剂
-
过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I−完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
O2  MnO(OH)2
MnO(OH)2 I2
I2  S4O62-
S4O62-
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式;_____________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L−1 Na2S2O3标准溶液13.50 mL,该水样中的溶解氧=______________________(用mg·L−1表示)
-
过氧化钙(CaO2)是一种难溶于水、溶于酸的白色固体,广泛用于果蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法。
回答下列问题:
(1)下图是某学生的过滤操作示意图,其操作不规范的是____。
a.漏斗末端颈尖未紧靠烧杯壁
b.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
c.将滤纸湿润,使其紧贴漏斗壁
d.玻璃棒用作引流
(2)步骤②需要在冰浴下进行,原因是_______。
(3)步骤③检验 CaO2· 8H2O是否洗净的方法是:取最后一次洗涤液少许于试管中,_______。
(4)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的缺点是_______。
(5)写出②发生的化学方程式_______。
(6)已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2 含量的装置(夹持装置省略)。
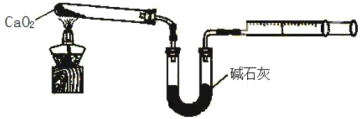
若所取产品质量是 m g,测得气体体积为 V mL(已换算成标准状况),则产品中CaO2的质量分数为_______(用字母表示)。
-
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②在第①步的生成的产物中加入30% H2O2,反应生成CaO2•8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2•8H2O,再脱水干燥得到CaO2。
完成下列填空:
(1)第①步反应的化学方程式为 ________。
(2)生产中可循环使用的物质是 。
(3)检验CaO2•8H2O是否洗净的方法是 ________________ 。
(4)已知CaO2在350℃迅速分解生成CaO和O2。如图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
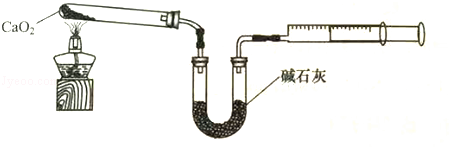
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为 (用字母表示)。过氧化钙的含量也可用重量法测定,需要测定的物理量有 ______ 。
-
氯化亚铜(CuCl)是一种白色粉末,不溶于水、乙醇(标准状况下沸点是78.2℃)及稀硫酸,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用于有机合成工业中的催化剂。以粗盐水(含氯化钙、硫酸镁等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如下:
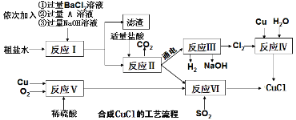
(1)A溶液中溶质的化学式是__________ ;
(2)写出反应V的化学方程式 _______________ ;
(3)反应VI的化学方程式是:2NaCl+2CuSO4+SO2+2H2O=2CuCl↓+2H2SO4+Na2SO4,反应中化合价升高的元素是___;
(4)本工艺中可循环利用的物质是NaOH和_____;
(5)反应VI后,过滤得到的CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却密封包装即得产品。真空干燥的目的是_______________。








