-
研究金属与硝酸的反应,实验如下。
| 实验 (20ºC) | 现象 |
| Ⅰ 过量铜粉、2 mL 0.5mol∙L-1HNO3 过量铜粉、2 mL 0.5mol∙L-1HNO3 | 无色气体(遇空气变红棕色),溶液变为蓝色 |
| Ⅱ 过量铁粉、2 mL 0.5mol∙L-1HNO3 过量铁粉、2 mL 0.5mol∙L-1HNO3 | 6mL无色气体(经检测为H2),溶液几乎无色 |
⑴Ⅰ中产生的无色气体是______。
⑵研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于NO3-,所以NO3-没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是______。
 乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
 补全Ⅱ中NO3-被还原为
补全Ⅱ中NO3-被还原为 的过程:NO3- + ______e- + ______= NH4+ + ______H2O
的过程:NO3- + ______e- + ______= NH4+ + ______H2O
⑶研究影响产生H2的因素
| 实验 | 现象 |
| Ⅲ 过量铁粉、2 mL 0.5mol∙L-1HNO3、40ºC 过量铁粉、2 mL 0.5mol∙L-1HNO3、40ºC | 3.4m L气体(经检测为H2),溶液略带黄色 |
| Ⅳ 过量铁粉、2 mL 0.5mol∙L-1HNO3、60ºC 过量铁粉、2 mL 0.5mol∙L-1HNO3、60ºC | 2.6m L气体(经检测为H2),黄色溶液 |
| Ⅴ 过量铁粉、2 mL 3mol∙L-1HNO3、20ºC 过量铁粉、2 mL 3mol∙L-1HNO3、20ºC | 无色气体(遇空气变红棕色),深棕色溶液 |
资料:Fe[(NO)]2+在溶液中呈棕色。
④对比Ⅱ、Ⅲ、Ⅳ,温度不同时收集到氢气的体积不同,原因是______。
⑤Ⅴ中无色气体是混合气体,则一定含有遇空气变红棕色的气体和______。
⑷根据实验,金属与硝酸反应时,影响硝酸的还原产物不同的因素有______。
-
研究金属与硝酸的反应,实验如下。
| 实验(20oC) | 现象 |
| Ⅰ.过量铜粉、2 mL 0.5 mol/L HNO3 | 无色气体(遇空气变红棕色),溶液变为蓝色 |
| Ⅱ.过量铁粉、2 mL 0.5 mol/L HNO3 | 6 mL无色气体(经检测为H2),溶液几乎无色 |
(1)Ⅰ中产生的无色气体是________。
(2)研究Ⅱ中的氧化剂
① 甲同学认为该浓度的硝酸中H+的氧化性大于NO3- ,所以NO3-没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是________。
②乙同学通过分析,推测出NO3-也能被还原,依据是________,进而他通过实验证实该溶液中含有NH4+,其实验操作是________。
③补全Ⅱ中NO3-被还原为NH4+的过程:NO3- +________e- + = NH4+ + H2O
(3)研究影响产生H2的因素
| 实验 | 现象 |
| Ⅲ.过量铁粉、2 mL 0.5 mol/L HNO3、40oC | 3.4 mL气体(经检测为H2),溶液略带黄色 |
| Ⅳ.过量铁粉、2 mL 0.5 mol/L HNO3、60oC | 2.6 mL气体(经检测为H2),黄色溶液 |
| Ⅴ.过量铁粉、2 mL 3 mol/L HNO3、20oC | 无色气体(遇空气变红棕色),深棕色溶液 |
资料: [Fe(NO)]2+在溶液中呈棕色。
④对比Ⅱ、Ⅲ、Ⅳ,温度不同时收集到氢气的体积不同,原因是________。
⑤Ⅴ中无色气体是混合气体,则一定含有遇空气变红棕色的气体和________。
(4)根据实验,金属与硝酸反应时,影响硝酸的还原产物不同的因素有________。
-
实验小组研究稀硝酸与铁粉的反应,进行如下实验:
向2.0mL 0.5mol/LHNO3中加入过量铁粉,生成无色气体,遇空气不变色。充分反应后,溶液几乎无色。
(1)N在元素周期表中的位置是_____。
(2)经检验,反应后的溶液中含有NH4+,检验NH4+的实验方案是_____。
(3)实验中,生成NH4+的离子方程式是_____。
(4)若反应后溶液中含有2×10﹣5 mol NH4+,HNO3得到的电子的物质的量为n(e﹣),则n(e﹣)_____1.6×10﹣4 mol(填“>”、“=”或“<”)。
-
文献记载,铁粉在稀硝酸中会放出氢气。某同学进行如下验证和对比实验。
实验I. 室温下 (20℃), 在恒压密闭容器内放入过量铁粉和 2.0 mL 0.5 mol·L–1 HNO3,立即有气体生成。充分反应后,所得溶液几乎无色,收集到无色气体 6.0 mL。将该气体通入有空气的试管,无明显变化。点燃气体,有尖锐爆鸣声,试管壁出现液滴。取反应后溶液,加入足量 NaOH 溶液得到灰绿色沉淀。煮沸时,蒸气略有刺激性气味并能使湿润红色石蕊试纸变蓝。
(1)气体产物为氢气的证据是______________________ 。
(2)根据实验现象, 写出铁粉与 0.5 mol·L–1 硝酸反应时还原反应的半反应方程式。① 2H+ + 2e– = H2↑; ②_____________ 。
(3)该同学对产生氢气的原因提出假设:
假设 1:该浓度的硝酸中 H+的氧化性大于NO3-;
假设 2: H+的还原速率大于NO3-的还原速率;
I. 验证假设 1:用____(Cu或Mg)粉与_____ 硝酸反应,说明假设1不成立。实验证据是______________________ 。
II. 验证假设 2: 改变条件重复实验 I,结果如下(气体成分和溶液成分检验的现象与实验 I 相似)。
| 序号 | 金属状态 | 反应温度 | 实验现象 |
| a | 铁粉 | 40℃ | 溶液略带黄色,气体 3.4 mL。 |
| b | 铁粉 | 60℃ | 黄色溶液,气体 2.6 mL。 |
①根据实验现象,你认为假设2是否成立?简述理由。__________________________
②试分析温度对铁粉与硝酸反应生成氢气体积的影响。__________________________
(4)改用 3 mol·L–1 HNO3与过量铁粉反应, 有无色气体生成, 溶液变为深棕色。气体接触空气显红棕色,不可燃。 根据以上结论解释生成还原产物的原因__________________________
(5)综上所述,金属与硝酸生成氢气,需要控制哪些条件?__________________________________
-
(本题共14分)某课外兴趣小组成员为研究金属铜与强酸的反应,将9.6克铜粉分为三等份,进行了如下一些实验,请完成有关计算。
54.取其中一份与100mL一定浓度的硝酸反应,待固体完全溶解,产生的一氧化氮和二氧化氮混合气体在标准状况下的体积为0.896L。然后将剩余溶液稀释至1000mL,测得pH=0。请计算:生成的混合气体中一氧化氮的体积分数为______、反应前硝酸的物质的量浓度是__________。
55.再取另一份铜粉投入100mLpH=0的硫酸和硝酸混合液中,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。求反应前混合溶液中所含硫酸的物质的量是多少?(写出计算过程)
56.用NaOH溶液吸收氮氧化物是防止NOx污染的一种方法。
原理为:2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O
取最后一份铜粉溶于a mol/L过量的硝酸溶液30.0 ml中,假设硝酸的还原产物只有一氧化氮和二氧化氮。待反应结束后,将所剩溶液加水稀释至1000 m L,测得c(NO3-)=0.200 mol/L。若反应所生成的混合气体能被NaOH溶液完全吸收,试讨论a的取值范围。
-
某学习小组研究大小相同、过量的去膜镁条与40mL0.1mol·L−1的盐酸和醋酸分别反应,相同条件下测得气体体积与反应时间关系如下表所示:
| 气体读数/mL | 5 mL | 10 mL | 15 mL | 20 mL | …… | 45 mL |
| A瓶(醋酸)/s | 155 | 310 | 465 | 565 | …… | 865 |
| B瓶(盐酸)/s | 7 | 16 | 30 | 64 | …… | 464 |
下列说法不正确的是( )
A.0~5mL时,A与B反应速率不同的原因是c(H+)不同所致
B.5~10mL时,A瓶平均反应速率为 mL·s−1
mL·s−1
C.0~20mL时,A瓶反应速率增大,可能是温度升高所致
D.0~45mL时段内,镁与盐酸反应的速率始终大于镁与醋酸反应的速率
-
甲醛(HCHO)与葡萄糖相似具有还原性。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在右图装置中进行实验,向a中加入0.5 mol/LCuSO4溶液50mL和5mol/LNaOH溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热a20分钟后冷却至室温。
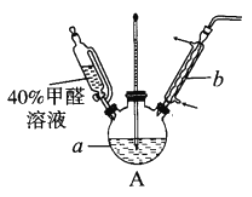
①盛装甲醛溶液的仪器名称是______________;
②能说明甲醛具有还原性的实验现象是______________。
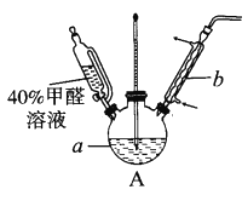
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分, 将装置A和下图中部分装置连接后进行实验。
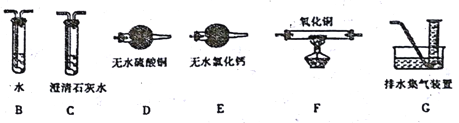
依次连接的合理顺序为A→B→____→____→____→____→G。
装置B的作用是____________。
证明有H2的实验现象是____________。
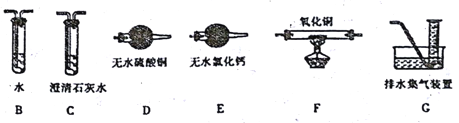
(3)反应后a中有红色固体产生,为研究其组成,进行如下实验(每步均充分反应):
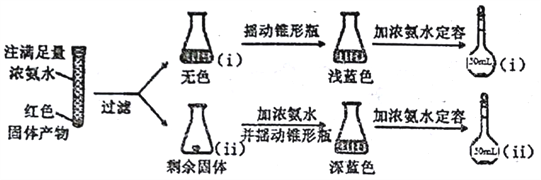
已知:Cu2O [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)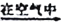 [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
① 锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为__________;
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容置瓶i相近。由此可知固体产物的组成及物质的量之比约为__________。
-
甲醛(HCHO)与葡萄糖相似具有还原性。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在右图装置中进行实验,向a中加入0.5 mol/LCuSO4溶液50mL和5mol/LNaOH溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热a20分钟后冷却至室温。
①盛装甲醛溶液的仪器名称是______________;
②能说明甲醛具有还原性的实验现象是______________。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分, 将装置A和下图中部分装置连接后进行实验。
依次连接的合理顺序为A→B→____→____→____→____→G。
装置B的作用是____________。
证明有H2的实验现象是____________。
(3)反应后a中有红色固体产生,为研究其组成,进行如下实验(每步均充分反应):
已知:Cu2O [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色) [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
① 锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为__________;
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容置瓶i相近。由此可知固体产物的组成及物质的量之比约为__________。
-
甲醛(HCHO)与葡萄糖相似具有还原性。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在右图装置中进行实验,向a中加入0.5 mol/LCuSO4溶液50mL和5mol/LNaOH溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热a20分钟后冷却至室温。
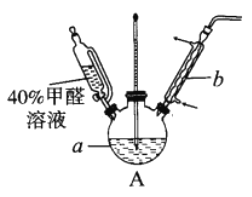
①盛装甲醛溶液的仪器名称是______________;
②能说明甲醛具有还原性的实验现象是______________。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分, 将装置A和下图中部分装置连接后进行实验。
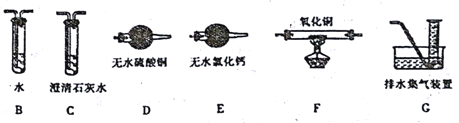
依次连接的合理顺序为A→B→____→____→____→____→G。
装置B的作用是____________。
证明有H2的实验现象是____________。
(3)反应后a中有红色固体产生,为研究其组成,进行如下实验(每步均充分反应):
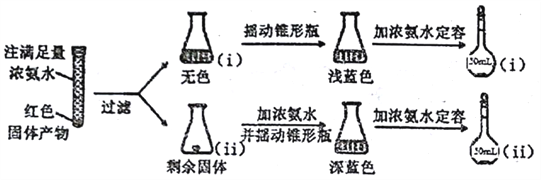
已知:Cu2O [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色) [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
① 锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为__________;
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容置瓶i相近。由此可知固体产物的组成及物质的量之比约为__________。
-
下列实验操作、现象和结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向盛有硝酸的烧杯中加入铜粉 | 溶液上方产生红棕色气体 | 证明该硝酸为浓硝酸 |
| B | 取10mL 0.1mol/L FeCl3溶液,滴加10滴0.1mol/L KI溶液,继续加入2mL苯,振荡静置,取下层溶液,滴入AgNO3溶液 | 上层呈紫红色,下层溶液滴入AgNO3溶液生成白色沉淀 | FeCl3与KI反应有一定的限度 |
| C | 向紫色石蕊试液中通入SO2 | 溶液褪色 | SO2具有漂白性 |
| D | 在一块除去铁锈的铁片上面滴1滴含有酚酞的食盐水,静置2~3min | 溶液边缘出现红色 | 铁片上发生了吸氧腐蚀 |
A.A B.B C.C D.D
乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
补全Ⅱ中NO3-被还原为
的过程:NO3- + ______e- + ______= NH4+ + ______H2O



 [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)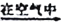 [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)


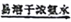 [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)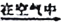 [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)


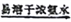 [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色) [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)