-
二氧化碳减排和再利用技术是促进工业可持续发展和社会环保的重要措施。将工业废气中的二氧化碳转化为甲醇,其原理是:
CO2(g)+3H2(g) H2O(g)+CH3OH(g) △H=-53.7kJ/mol
H2O(g)+CH3OH(g) △H=-53.7kJ/mol
(1) 308K时,向2L密闭容器中通入0.04 mol CO2和0.08 mol H2,测得其压强(p)随时间(t)变化如图1中曲线I所示。


①反应开始至达平衡时,υ(H2)=________;该温度下反应的平衡常数为______mol-2·L2。
②若只改变某一条件,其他条件相同时,曲线变化为II,则改变的条件是____。
(2)还可以通过以下途径实现CO2向CH3OH的转化:
反应I:CO2(g)+H2(g) H2O(g)+CO(g) △H<0
H2O(g)+CO(g) △H<0
反应Ⅱ:2H2(g)+CO(g) CH3OH(g) △H<0
CH3OH(g) △H<0
反应I和反应Ⅱ的平衡常数K随温度T的变化如图2所示。
①根据图中数据分析可知,T1____T2(填“>”、“<”或“=”);T2时CO2转化为CH3OH的平衡常数K=_______;
②目前,许多国家采用CO2代替CO(以煤和天然气为原料)生产CH3OH,其优点是_________。
(3)用电解法可将CO2转化为多种燃料,原理如图3。铜电极上产生HCOOH的电极反应式为_________。

-
氮氧化物( NOx)、CO2和SO2等气体会造成环境问题。对燃煤废气进行化学方法处理,可实现绿色环保、节能减排、废物利用等目的。
(1)已知氢气与甲醇的燃烧热分别为285.8kJ·mol-1、726.5 kJ·mol-1,则CO2与H2反应产生液态甲醇与液态水的热化学方程式为___________________________________
(2)已知在一定温度下将6molCO2和8mol H2充入容器为2L的密闭容器中发生如下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1 ,则
①该反应自发进行的条件是 _______________(填“低温”“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 _____________(填字母)
a.混合气体的平均相对分子质量保持不变 b.CO2和H 2的物质的量之比保持不变
c.CO2和H 2的转化率相等 d.3v正(H2)=v逆(CH3OH)
e.1mol CO2生成的同时有3mol H—H键断裂
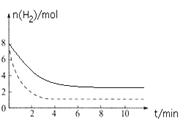
③H2的物质的量随时间变化曲线如图实线所示,仅改变某一条件再进行实验,测得H2物质的量随时间变化曲线如图虚线所示。与实线相比,虚线改变的条件可能是__________________
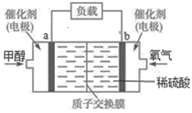
(3)如图是某甲醇燃料电池工作的示意图。质子交换膜(只有质子能够通过)左右两侧的溶液均为1L 2mol·L -1H2SO4溶液。电极a上发生的电极反应式为 _____________________,当电池中有1mol e -发生转移时左右两侧溶液的质量之差为____g(假设反应物耗尽,忽略气体的溶解)。
-
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是
①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转化技术;
④田间焚烧秸秆;⑤推广使用节能环保材料。
A.①③⑤ B.②③⑤ C.①②④ D.②④⑤
-
能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。
(1)利用工业废气 CO2 可制取甲醇。 下列两个反应的能量关系如图:
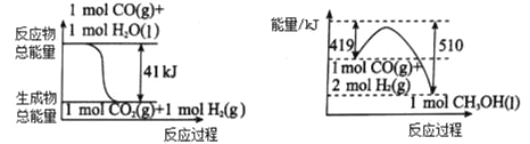
则 CO2与 H2 反应生成 CH3OH 的热化学方程式为_______________________。
(2)CH4 和 H2O(g)通过下列转化也可以制得 CH3OH;
I. CH4(g)+H2O(g) CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
II. CO(g)+2H2(g)  CH3OH(g) △H<0
CH3OH(g) △H<0
将 1.0 mol CH4和 3.0 mol H2O(g)通入反应室(容积为 100 L)中,在一定条件下发生反应 I, CH4 的转化率与温度、压强的关系如下图所示:
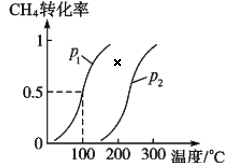
①已知压强 p1, 温度为 100 ℃时反应 I 达到平衡所需的时间为 5 min,则用 H2表示的平均反应速率为______________;
②图中的 p1_______p2(填“<”、 “>”或“=”),判断的理由是________________________。
③若反应 II 在恒容密闭容器进行,下列能判断反应 II 达到平衡状态的是_________(填字母)。
a.CH3OH 的生成速率与消耗 CO 的速率相等
b.混合气体的密度不变
c混合气体的总物质的量不变
d.CH3OH、CO、H2的浓度都不再发生变化
④ 在某温度下,将一定量的CO和 H2投入10 L 的密闭容器中发生反应 II, 5 min 时达到平衡,各物质的物质的浓度(mol·L ﹣1)变化如下表所示:
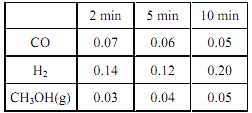
若 5 min 时只改变了某一条件,则所改变的条件是_____________; 10 min 时测得各物质浓度如上表,此时 v正_______v逆(填“<”、 “>”或“=”)。
-
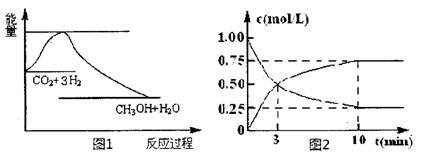
(14分)实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和 4molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=___________;H2的转化率w(H2)=_________________。
②该反应的平衡常数表达式K=____________。
③下列措施中能使化学平衡向正反应方向移动的是___________(填字母)。
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入1molCO2和4 molH2
(3)25℃,1.01×10 5Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:__________________________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有_____________;其正极的电极反应式是:_____________________。
-
能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图:
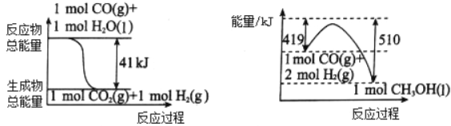
则CO2与H2反应生成CH3OH的热化学方程式为_____________________
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH;
I.CH4(g)+H2O(g) CO(g)+3H2(g) △H1>0
CO(g)+3H2(g) △H1>0
Ⅱ.CO(g)+2H2(g) CH3OH(g) △H2<0
CH3OH(g) △H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如下图所示。
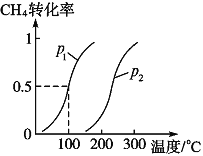
①已知温度为T1℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为________;
②图中的p1_______p2(填“<”、“>”或“=”),判断的理由是________________________。
③若反应Ⅱ在恒容密闭容器进行,下列能判断反应Ⅱ达到平衡状态的是_________(填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的总物质的量不变
d.CH3OH、CO、H2的浓度都不再发生变化
④在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol·L﹣1)变化如下表所示:
| 2min | 5min | 10min |
| CO | 0.07 | 0.06 | 0.05 |
| H2 | 0.14 | 0.12 | 0.20 |
| CH3OH | 0.03 | 0.04 | 0.05 |
若5min时只改变了某一条件,则所改变的条件是_____________;10min时测得各物质浓度如表,10min时v正_______v逆(填“<”、“>”或“=”)。
-
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),图1表示该反应过程中能量变化:
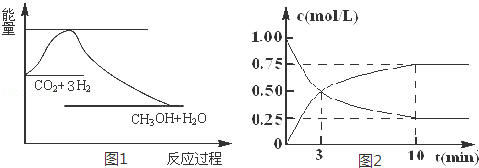
(1)关于该反应的下列说法中,正确的是 (填字母).
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CO2和CH3O(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,CO2的平均反应速率v(CO2)= mol/(L.min)
②该反应的平衡常数表达式K=
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)
A.升高温度 B.将CH3OH(g)及时液化抽出 C.选择高效催化剂
(3)25℃,1.01105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式: .
-
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
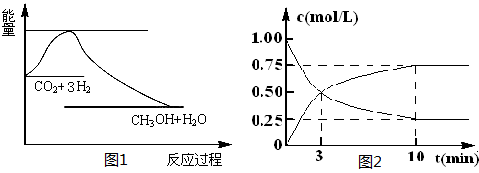
(1)关于该反应的下列说法中,正确的是________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) =________ ;H2的转化率w(H2) =。
②该反应的平衡常数表达式K=________。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有________;其正极的电极反应式是:________。
-
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是
CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是
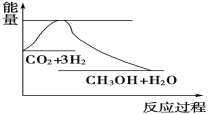
A. ΔH>0,ΔS>0 B. ΔH>0,ΔS<0 C. ΔH<0,ΔS>0 D. ΔH<0,ΔS<0
-
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是
CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是
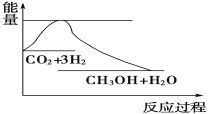
A. ΔH>0,ΔS>0 B. ΔH>0,ΔS<0 C. ΔH<0,ΔS>0 D. ΔH<0,ΔS<0
H2O(g)+CH3OH(g) △H=-53.7kJ/mol


H2O(g)+CO(g) △H<0
CH3OH(g) △H<0












