-
(12分)金属铁是应用广泛,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取3.25g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用1.0 mol·L-1的盐酸中和滴定,正好中和时消耗盐酸60.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值:
(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.8,则该样品中FeCl3的物质的量分数为 。
(3)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,其中Zn极的电极反应式为 ,K2FeO4的电极反应式为 。
高二化学填空题极难题查看答案及解析
-
铝、铁是重要的金属,其单质及化合物有着广泛的应用,完成下列填空:
(1)铝元素在周期表中的位置是 ,写出其最高价氧化物对应水化物的电离方程式 。
(2)画出铁原子的结构示意图 。与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为 。
(3)在FeC13稀溶液中滴加KSCN溶液后呈红色,反应的离子方程式是 ;在其中加入少量KCl固体,溶液的颜色 (选填“变深”,“变浅”或“不变”)。
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加溶液,则不呈红色,若再加入足够量FeC13溶液,又会呈现红色。请试对上述实验现象作出解释 。
高二化学填空题简单题查看答案及解析
-
硅是一种重要的非金属单质,硅及其化合物的用途非常广泛。根据所学知识回答硅及其化合物的相关问题。
(1)硅的最高价氧化物对应水化物化学式可能是_____。
A.H4SiO3 B.H2SiO3 C.H3SiO4 D.HSiO4
(2)金刚石与金刚砂(SiC)具有相似的晶体结构,在金刚砂的空间网状结构中,碳原子、硅原子交替以共价 单键相结合。金刚砂属于_____晶体。金刚砂的熔点比金刚石的熔点_____;金刚砂的结构中,一个硅原子周围结合_____个碳原子。
(3)晶体硅的微观结构与金刚石相似,晶体硅中 Si—Si 键之间的夹角大小约为_____。 下表列有三种物质(晶体)的熔点:
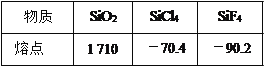
简要解释熔点产生差异的原因:
①SiO2 和 SiCl4:_________________________;
②SiCl4和 SiF4:___________________________。
高二化学综合题中等难度题查看答案及解析
-
关于C、N、Si、S等非金属元素及其化合物的下列说法错误的是( )
A. 它们都能以游离态存在于自然界中
B. 氮氧化物、二氧化硫是形成酸雨的主要物质
C. 它们的最高价氧化物都能与强碱反应生成含氧酸盐
D. 加热条件下,碳、硫单质都能与浓硝酸、浓硫酸发生反应
高二化学选择题困难题查看答案及解析
-
同周期的X、Y、Z三元素,它们最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是
A. 含氧酸的酸性H3ZO4>H2YO4>HXO4
B. 非金属性X>Y>Z
C. 元素的负化合价的绝对值按X、Y、Z变小
D. 气态氢化物的稳定性按X、Y、Z的顺序增强
高二化学选择题中等难度题查看答案及解析
-
已知X、Y是第三周期的非金属元素,且电负性X>Y,下列说法错误的是( )
A.X与Y形成化合物中,X显负价,Y显正价
B.第一电离能Y一定小于X
C.最高价含氧酸的酸性:X强于Y
D.气态氢化物的稳定性:HnY小于HmX高二化学选择题中等难度题查看答案及解析
-
已知X、Y是第三周期的非金属元素,且电负性X>Y,下列说法错误的是
A.X与Y形成化合物中,X显负价,Y显正价
B.第一电离能Y一定小于X
C.最高价含氧酸的酸性:X强于Y
D.气态氢化物的稳定性:HnY小于HmX
高二化学选择题中等难度题查看答案及解析
-
已知X、Y是第三周期的非金属元素,且电负性X>Y,下列说法错误的是
A X与Y形成化合物中,X显负价,Y显正价 B第一电离能Y一定小于X
C 最高价含氧酸的酸性:X强于Y D气态氢化物的稳定性:HnY小于HmX
高二化学选择题简单题查看答案及解析
-
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
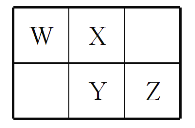
A. X、Y、Z中最简单氢化物稳定性最弱的是Y
B. Z元素氧化物对应水化物的酸性一定强于Y
C. X元素形成的单核阴离子还原性大于Y
D. Z元素单质在化学反应中只表现氧化性
高二化学单选题中等难度题查看答案及解析
-
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.元素氧化物对应水化物的酸性:Z>Y
C.元素形成的单核阴离子还原性:X>Y
D.Z元素单质在化学反应中只表现氧化性
高二化学选择题中等难度题查看答案及解析