-
信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
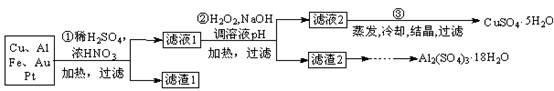
回答下列问题:
⑴第①步Cu与酸反应的离子方程式为;得到滤渣1的主要成分为________。
⑵第②步加入H2O2的作用是________,使用H2O2的优点是________;调节pH的目的是使________生成沉淀。
⑶用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________。
⑷由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
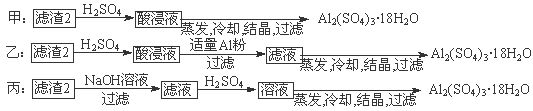
上述三种方案中,________方案不可行,原因是________;
从原子利用率角度考虑,________方案更合理。
⑸探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g 试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol/L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++ H2Y2-=CuY2-+ 2H+
写出计算CuSO4·5H2O质量分数的表达式ω=________;
下列操作会导致CuSO4·5H2O含量测定结果偏高的是________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除静可与EDTA反应的干扰离子
-
信息时代产生的大量电子垃圾对环境构成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
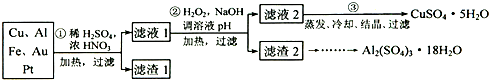
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为________;得到滤渣1的主要成分为(填化学式)________.
(2)第②步加H2O2的作用是________,使用H2O2的优点是________;调溶液pH的目的是使________生成沉淀.
(3)用第③步所得CuSO4•5H2O制备无水CuSO4的方法是________.
(4)由滤渣2制取Al2(SO4)3•18H2O,探究小组设计了三种方案:
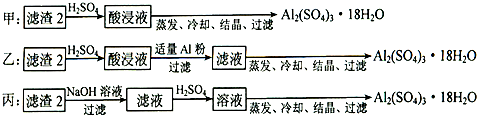
上述三种方案中,________方案不可行,原因是________:从原子利用率角度考虑,________方案更合理.
-
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
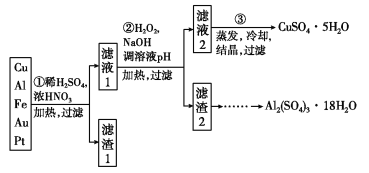
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为__________________;得到滤渣1的主要成分为______(写化学式)。
(2)第②步加H2O2的作用是______________________(用离子方程式表示);使用H2O2的优点是____________;调溶液pH的目的是使____________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是______________。
-
废电池处理不当不仅造成浪费,还会对环境造成严重污染,对人体健康也存在极大的危害。有同学想变废为宝,他的以下想法你认为不正确的是
A.把锌皮取下洗净用于实验室制取氢气
B.碳棒取下用作电极
C.把铜帽取下洗净回收利用
D.电池内部填有氯化铵等化学物质,将废电池中的黑色糊状物用作化肥
-
下列做法不利于环境保护的是
A. 为减少温室气体排放,应减少燃煤,大力发展新能源,如核能、风能、太阳能
B. 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
C. 为节约垃圾处理的费用,大量采用垃圾的填埋
D. 在屋顶安装太阳能热水器为居民提供生活用热水
-
电子工业中,可用FeCl3—HCl溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
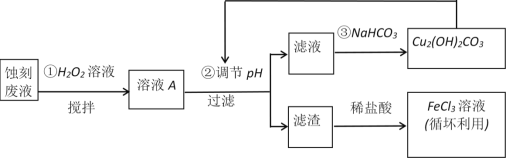
请回答:
(1)把FeCl3溶液蒸干、灼烧,最后得到的主要固体产物是____________。
(2)FeCl3蚀刻液中加入盐酸的目的是______________________________。
(3)步骤①中加入H2O2溶液的目的是(用离子方程式表示)_____________________。
(4)已知:生成氢氧化物沉淀的pH如下表
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是________________。
(5)上述流程路线中,除FeCl3溶液外,还可用于循坏利用的物质是__________________。
-
(18分)废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:
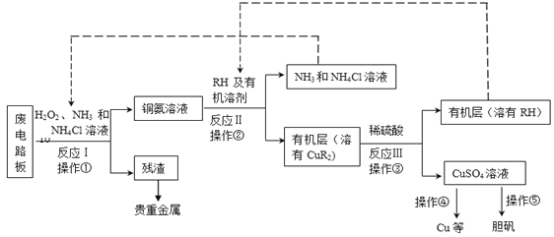
回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3)42+,反应中H2O2的作用是 。写出操作①的名称: 。
(2)反应II是铜氨溶液中的Cu(NH3)42+与有机物RH反应,写出该反应的离子方程式: 。操作②用到的主要仪器名称为 ,其目的是(填序号) 。
a.富集铜元素
b.使铜元素与水溶液中的物质分离
c.增加Cu2+在水中的溶解度
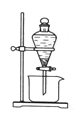
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和 。若操作③使用下图装置,图中存在的错误是 。
(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是 。操作⑤由硫酸铜溶液制胆矾的主要步骤是 。
(5)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是 。循环使用的NH4Cl在反应Ⅰ中的主要作用是 。
-
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
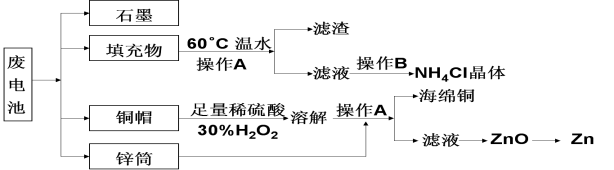
(1)填充物用60℃温水溶解,目的是_____________________。
(2)操作A的名称为______________。
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示)。铜帽溶解完全后,可采用___________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为_______________________。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 __________________________________。
①当1 mol MnO2参加反应时,共有_____________mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式:_____________。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。 在不同pH下,KMnO4
在不同pH下,KMnO4 溶液对Hg的吸收率及主要产物如下图所示:
溶液对Hg的吸收率及主要产物如下图所示:
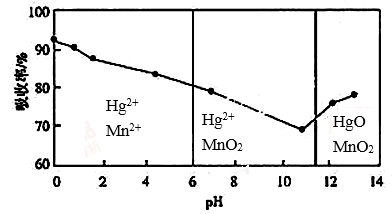
根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率_____________________。
②在强酸性环境下Hg的吸收率高的原因可能是_______________KMnO4在酸性条件下强。
-
环境污染已经成为社会面临的重大威胁,下列名词都与环境污染有关:①:白色垃圾;②:光化学烟雾;③:重金属污染;④:水华与赤潮;⑤:臭氧空洞;⑥:酸雨.(填序号)
(1)大量使用聚乙烯制品造成污染的是________
(2)二氧化氮在空气中带来的两种污染是________
(3)富含氮磷元素的污水造成的污染是________
(4)铅、汞、铜造成的污染成为________.
-
下列做法不利于环境保护的是( )
A. 为减少温室气体排放,应减少燃煤,大力发展新能源,如核能、风能、太阳能
B. 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
C. 为节约垃圾处理的费用,大量采用垃圾的填埋
D. 在屋顶安装太阳能热水器为居民提供生活用热水









