-
I.(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率VA VC(同上)。
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率VA VC(同上)。

(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,
每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①该反应的平衡常数K的值为 ;
②若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol/L。
③计算②中条件下达到平衡后混合气体的平均相对分子质量为 ;(结果保留小数点后一位)
II. 在0.5 L的密闭容器中,一定量的H2和N2进行如下化学反应:3H2(g)+N2(g) 2NH3(g) △H <0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。
2NH3(g) △H <0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
④比较K1,K2的大小,K1_________K2(填写“ >”、“=”或“<”)。
⑤在400℃时,当测得NH3和N2、H2的物质的量分别为3mol和1 mol、2 mol时,则该反应的 V(H2)正_________ V (H2)逆(填写“>”、“=”或“<”)。
-
对于反应:N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的对应压强下的平衡点),下列说法正确的是
2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的对应压强下的平衡点),下列说法正确的是

A.A、C两点的正反应速率的关系为v(A)>v(C)
B.A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C.维持P1不变,E→A所需时间为x;维持P2不变,D→C所需时间为y,则:x<y
D.使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上讲可选用的条件是从P1突然加压到P2,再由P2无限缓慢降压到P1
-
对于反应N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积分数(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
2NO2(g)在温度一定时,平衡体系中NO2的体积分数(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
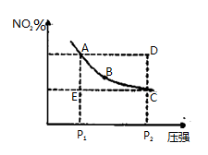
A.A、C两点的正反应速率的关系为A C
C
B.A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C.维持P1不变,E→A所需时间为x;维持P2不变, D→C所需时间为y,则x<y
D.使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从P1突然加压至P2,再由P2无限缓慢降压至P1
-
对于反应N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积分数(NO2)随压强的变化情况如图所示(实线上的点为对应压强下的平衡点),下列说法正确的是
2NO2(g)在温度一定时,平衡体系中NO2的体积分数(NO2)随压强的变化情况如图所示(实线上的点为对应压强下的平衡点),下列说法正确的是
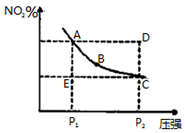
A.A、C两点的正反应速率的关系为v(A)>v(C)
B.A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C.维持P1不变,E→A所需时间为x;维持P2不变,D→C所需时间为y,则x<y
D.使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从P1突然加压至P2,再由P2无限缓慢降压至P1
-
对于反应N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)
2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)
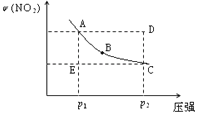
(1)B、C两点的反应速率的关系为B_________C(填“>”“<”或“=”)。
(2)当反应处于A状态时,V正_____V逆(填“>”“<”或“=”)
(3)由D状态转变为C状态后,混合气体的总物质的量会______(填“增大”、“减小”)。
(4)若在注射器中盛有一定量NO2,向内推活塞至原有体积的3/4,达到平衡时其中气体颜色较初始颜色如何变化_______,其原理为______________________。
-
对于反应N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
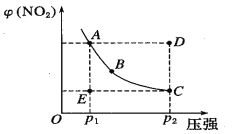
A. A、C两点的正反应速率的关系为A>C
B. A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C. 维持P1不变,E→A所需时间为x;维持P2不变,D→C所需时间为y,则x<y
D. 使E状态从水平方向到达C状态,从理论上来讲可选用的条件是从P1突然加压至P2
-
反应N2O4(g)  2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
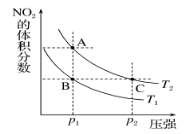
A.A、C两点的NO2的体积分数:C > A
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.若p2 > p1,则化学平衡常数KA > KC
-
反应N2O4(g) 2NO2(g)ΔH =+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强(缩小体积)的 变化曲线如图所示。下列说法正确的是 ( )
2NO2(g)ΔH =+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强(缩小体积)的 变化曲线如图所示。下列说法正确的是 ( )
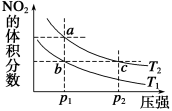
A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a深,c浅
C.由状态b到状态a,可以用加热的方法
D.a、c两点气体的平均相对分子质量:a>c
-
对于反应N2O4(g) 2NO2(g),在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
2NO2(g),在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
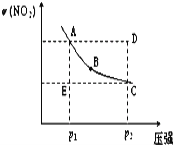
A. A、C两点的正反应速率的关系为v(A)<v(C)
B. A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C. 维持p1不变,E→A所需时间为x;维持p2不变,D→C所需时间为y,则x<y
D. 使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从p1突然加压至p2,再由p2无限缓慢降压至p1
-
对于N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)。
2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)。
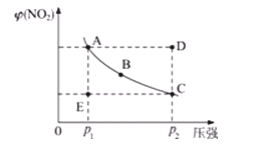
(1)A、C两点的正反应速率的关系为A__(填“<”“>”或“=”)C。
(2)A、B、C、D、E各状态中,v(正)<v(逆)的是__。
(3)维持p1不变,E→A所需时间为x;维持p2不变,D→C所需时间为y,则x__y(填“<”“>”或“=”)。
(4)欲要求使E状态从水平方向到达C状态后,再沿平衡曲线以达A状态,从理论上来讲,可选用的条件是__。
A.从p1无限缓慢加压至p2,再由p2无限缓慢降压至p1
B.从p1突然加压至p2,再由p2无限缓慢降压至p1
C.从p1突然加压至p2,再由p2突然降压至p1
D.从p1无限缓慢加压至p2,再由p2突然降压至p1
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率VA VC(同上)。

2NH3(g) △H <0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。








