-
[化学——选修3:物质结构与性质](15分)
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为____ ,该能层具有的原子轨道数为____ 、电子数为 。
(2)硅主要以硅酸盐、____ 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献____ 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4C1在液氨介质中反应制得SiH4,该反应的化学方程式为___ 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:

①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是____ 。
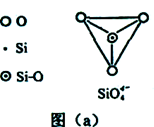
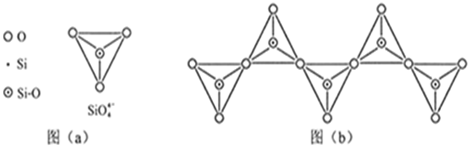
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 。Si与O的原子数之比为 。
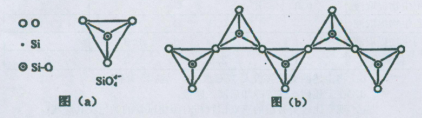
-
[化学-选修3:物质结构与性质]
硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______、电子数为______.
(2)硅主要以硅酸盐、______等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以______相结合,其晶胞中共有8个原子,其中在面心位置贡献______个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为______.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/ | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是______.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是______.
(6)在硅酸盐中,SiO 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为______,Si与O的原子数之比为______,化学式为______.
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为______,Si与O的原子数之比为______,化学式为______.
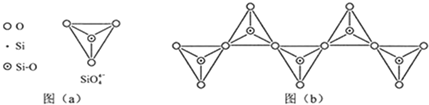
-
[化学—选修3:物质结构与性质](15分)
硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为________,该能层具有的原子轨道数为________、电子数为________。
(2)硅主要以硅酸盐、________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________相结合,其晶胞中共有8个原子,其中在面心位置贡献________个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/(kJ?mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是________。
(6)在硅酸盐中,SiO4- 4四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为________,Si与O的原子数之比为________,化学式为________。
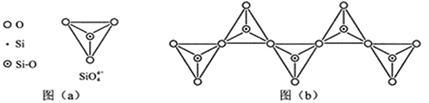
-
[化学—选修3:物质结构与性质]
硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为_______,该能层具有的原子轨道数为________、电子数为___________。
(2)硅主要以硅酸盐、___________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以___________相结合,其晶胞中共有8个原子,其中在面心位置贡献__________个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为___________________________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是______。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是___________________________。
(6)在硅酸盐中,SiO4- 4四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为______,Si与O的原子数之比为_________,化学式为__________________。
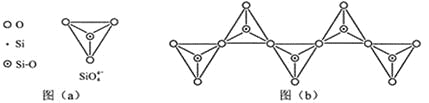
-
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为________,该能层具有的原子轨道数为________、电子数为________。
(2)硅主要以硅酸盐、________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以相结合,其晶胞中共有8个原子,其中在面心位置贡献________个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C一O | Si—Si | Si—H | Si一O |
| 键能/(kJ·mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是________。
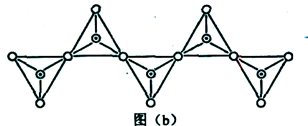
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为________。Si与O的原子数之比为________。
-
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号________________ ,该能层具有的原子轨道数为________________、电子数为________________。
(2)硅主要以硅酸盐、________________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________________相结合,其晶胞中共有8个原子,其中在面心位置贡献________________个原子。
(4)单质硅可通过甲硅烷(SiH4) 分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
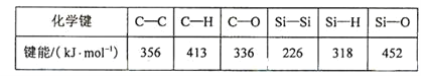
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___________SiH4的稳定性小于CH4,更易生成氧化物,原因是 ________________。
(6)在硅酸盐中,SiO44+四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为________________。Si与O的原子数之比为 ________________ 化学式为________.
-
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号________________________________________________________ ,该能层具有的原子轨道数为________________________________________________ 、电子数为________________________________________________________________________ 。
(2)硅主要以硅酸盐、________________________________________________________ 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 ________________________________________________________________相结合,其晶胞中共有8个原子,其中在面心位置贡献________________________________________________________ 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为________________________________________________________________________________________________________________ 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 ________________________________________________________________________________________________________________________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是________________________________________________________________________________________________________________________________________________________________ ________________________。
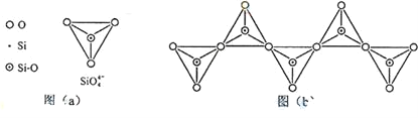
(6)在硅酸盐中,SiO44-四面体(如下图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为________________________ ________________________________________________________________________。Si与O的原子数之比为________ ________________________________________________化学式为________________________ 。
-
硅是重要的半导体材料,是构成现代电子工业的基础。硅及其化合物在工业中应用广泛,在工业上,高纯硅可以通过下列流程制取:

完成下列填空:
(1)氯原子核外有_______种不同能量的电子,硅原子的核外电子排布式是_______________。
(2)碳与硅属于同主族元素,熔沸点SiO2 ________CO2 (填写“>”、“<”或“=”),其原因是_____________________________________________________。
(3)流程中由SiO2制粗硅的反应不能说明碳的非金属性强于硅,原因是_________________;请写出一个能说明碳的非金属性强于硅的化学方程式______________________________。
(4)SiHCl3(g) + H2(g) Si(s) + 3HCl(g) -Q (Q>0)
Si(s) + 3HCl(g) -Q (Q>0)
①上述反应的平衡常数表达式K=_____________;能使K增大的措施是_______________。
②一定条件下,在固定容积的密闭容器中,能表示上述反应达到平衡状态的是________(选填编号)。
a.3v逆(SiHCl3)=v正(HCl) b.混合气体的压强不变
c.K保持不变 d.c(SiHCl3)∶c(H2)∶c(HCl)=1∶1∶3
③一定温度下,在2L密闭容器中进行上述反应,5min后达到平衡,此过程中固体质量增加0.28g,此时HCl的化学反应速率为 ________________ 。
-
铜、硼、硅、砷等元素的化合物是制造新型激光武器和新型太阳能电池的重要材料。回答下列问题:
(1)基态硅原子电子占据的最高能层符号是_____,其中能量最高的电子所占据能级的原子轨道有_____个伸展方向,原子轨道呈_____形。
(2)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有____________。
(3)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的第一电离能从大到小的顺序为________(用元素符号表示)。H2SeO3的酸性_______H2SeO4(填“强于”或“弱于”),原因是___________(从分子结构的角度回答)。
(4)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。它的晶体结构如下左图所示。六方相氮化硼______π键(填“含有”或“不含”),其质地软的原因是_________。NaBH4是一种重要的储氢载体,阴离子的的立体结构为_______。
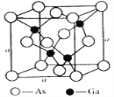
(5)砷化镓是优良的第三代半导体材料。如上图所示为GaAs的晶胞结构。
①与GaAs互为等电子体的一种原子晶体的化学式为________。
②已知晶胞的密度是ρ g·cm−3,阿伏加德罗常数值为NA,棱长a=_____pm。
-
硅是重要的半导体材料,构成现代电子工业的基础。硅及其化合物在工业中应用广泛,在国防和航天工业中亦有许多用途。
(1)硅原子中最外层电子排布式为___,该层电子的电子云有___种不同的伸展方向。
(2)温石棉矿是一种硅酸盐类矿物,化学式写作氧化物形式为6MgO•4SiO2•4H2O,其中原子半径最大的元素在周期表中的位置是___。SiO2存在与金刚石结构类似的晶体,其中硅氧原子之间以___相结合。
a.离子键 b.极性键 c.非极性键 d.范德华力
(3)甲硅烷(SiH4)是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下,10gSiH4自燃放出热量446kJ,请写出其燃烧的热化学方程式:___;
(4)SiH4的热稳定性不如CH4,其原因是___。
工业上硅铁可以用于冶镁。以煅白(CaO•MgO)为原料与硅铁(含硅75%的硅铁合金)混合,置于密闭设备中于1200℃发生反应:2(CaO•MgO)(s)+Si(s) Ca2SiO4(l)+2Mg(g)
Ca2SiO4(l)+2Mg(g)
(5)常温下镁的还原性强于硅。上述方法能够获得镁的原因是:___。
(6)若上述反应在容积为aL的密闭容器中发生,一定能说明反应已达平衡的是___(选填编号)。
a.反应物不再转化为生成物
b.炉内Ca2SiO4与CaO•MgO的质量比保持不变
c.反应放出的总热量不再改变
d.单位时间内,n(CaO•MgO)消耗:n(Ca2SiO4)生成=2:1
若bg煅白经tmin反应后转化率达70%,该时段内Mg的生成速率是___。












