-
乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。裂解的副反应为C4H10(g,正丁烷)  CH4(g)+C3H6(g)
CH4(g)+C3H6(g)
请回答下列问题
(1)化学上,将稳定单质的能量定为0,由元素的单质化合成单一化合物时的反应热叫该化合物的生成热,生成热可表示该物质相对能量。25℃、101kPa 几种有机物的生成热如下表所示:
| 物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
| 生成热/ kJ·mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
由正丁烷裂解生成乙烯的热化学方程式为_______________________________。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况能说明该反应达到平衡状态的是__________(填标号)
A.气体密度保持不变 B.c(C2H4)·c(C2H6)/c(C4H10)保持不变
C.反应热保持不变 D.正丁烷分解速率利乙烷消耗速率相等
②为了提高反应速率和反应物的转化率,可采收的措施是______________________________。
(3)向密闭容器中充入正丁烷,在一定条件(浓度、催化剂及压强等) 下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随着温度升高,乙烯产率降低,可能的原因是____________________________________________。
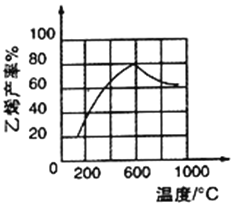
(4)在一定温度下向10L 恒容密闭容器中充入2mol 正丁烷,反应生成乙烯和乙烷,经过10min 达到平衡状态,测得平衡时气体压强是原来的1.75 倍。
①0~10min 内乙烷的生成速率v(C2H6)=__________ mol·L-1·min-1
②上述条件下,正丁烷的平衡转化率为______________,该反应的平衡常数K 为____________。 (5) 丁烷一空气燃料电池以熔融的K2CO3( 其中不含O2-和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e-=26CO32-,则负极反应式为_______________________。
-
乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。
主反应:C4H10(g,正丁烷)  C2H4(g)+C2H6(g) △H1
C2H4(g)+C2H6(g) △H1
副反应:C4H10 (g,正丁烷)  CH4(g)+C3H6(g) △H2
CH4(g)+C3H6(g) △H2
回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时的释放或吸收能量生成热,生成热可表示该物质相对能量。下表为25℃、101kPa下几种有机物的生成热:
| 物质 | 曱烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
| 生成热/kJ·mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
①表格中的物质,最稳定的是_________________(填结构简式)。
②上述反应中,△H1=______kJ/mol。
③书写热化学方程式时,要标明“同分异构体名称”,其理由是________________________。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况表明该反应达到平衡状态的是_______ (填代号)。
A.气体密度保持不变 B. [c(C2H4)·c(C2H6)]/ c(C4H10)保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
②为了同时提高反应速率和转化率,下列措施可采用的是 _____(填代号)。
A.加入高效催化剂 B.升高温度 C.充入乙烷 D.减小压强
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等) 下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随若温度升高,乙烯产率降低,可能的原因是__________(填代号)。
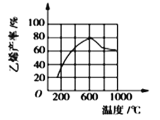
A.平衡常数降低 B.活化能降低 C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1L恒容密闭容器中充入2mol正丁烷,反应生成乙烯和乙烷,经过10min 达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10min内乙烯的生成速率v(C2H4)为________ mol·L-1·min-1。
②上述条件下,该反应的平衡常数K为____________。
(5)丁烷-空气燃料电池以熔融的K2CO3为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的负极反应式为______________________________。
-
乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。
主反应:C4H10(g,正丁烷) C2H4(g)+C2H6(g) △H1
C2H4(g)+C2H6(g) △H1
副反应:C4H10 (g,正丁烷) CH4(g)+C3H6(g) △H2
CH4(g)+C3H6(g) △H2
回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时释放或吸收的能量叫做生成热,生成热可表示该物质相对能量。下表为25℃、101kPa下几种有机物的生成热:
| 物质 | 曱烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
| 生成热/kJ·mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
①书写热化学方程式时,要标明“同分异构体名称”,其理由是_______________________。
②上述反应中,△H1=______kJ/mol。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况表明该反应达到平衡状态的是_______ (填代号)。
A.气体密度保持不变 B. [c(C2H4)·c(C2H6)]/ c(C4H10)保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
②为了同时提高反应速率和转化率,可采用的措施是 ________________。
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等) 下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随若温度升高,乙烯产率降低,可能的原因是__________(填代号)。
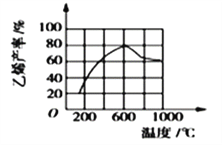
A.平衡常数降低 B.活化能降低
C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1L恒容密闭容器中充入2mol正丁烷,反应生成乙烯和乙烷,经过10min 达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10min内乙烯的生成速率v(C2H4)为________ mol·L-1·min-1。
②上述条件下,该反应的平衡常数K为____________。
(5)丁烷-空气燃料电池以熔融的K2CO3为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的负极反应式为______________________________。
(6)K2CO3可由二氧化碳和氢氧化钾溶液反应制得。常温下,向1 L pH=10的KOH溶液中持续通入CO2,通入CO2的体积(V)与溶液中水电离出的OH-浓度的关系如图所示。C点溶液中各离子浓度大小关系为_________________________________________。
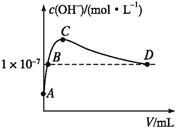
-
丁烷的催化裂解可按下列两种方式进行:C4H10→C2H6+C2H4; C4H10→CH4+C3H6;某化学兴趣小组的同学为探究丁烷裂解气中CH4和C2H6的比例关系,设计如图所示实验:
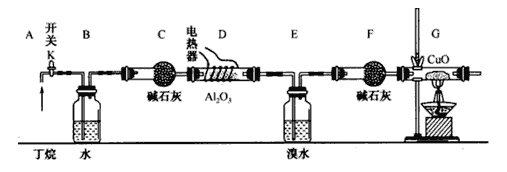
注:CuO能将烃氧化成CO2和H2O;A12O3是丁烷裂解的催化剂,G后面装置已省略。如图连接好装置后(部分夹持装置已略去),需进行的实验操作有:
①给D、G装置加热:②检査整套装置的气密性;③排尽装置中的空气。
(1)这三步操作的先后顺序依次是____________。
(2)简要说明检验空气排尽的方法:_______________________________________________。
(3)B装置所起的作用是__________________________________________。
(4)假设丁烷完全裂解,流经各装置中的气体能完全反应。当(E和F)装置的总质量比反应前增加了 1.82g, G装置中固体质量减少了 4.l6g,则丁烷的裂解产物中n(CH4)∶n(C2H6)=_____________。
(5)若对E装置中的混合物再按以下流程实验:

①分离操作I、Ⅱ的名称是I_____________、 II_______________;
②Na2SO3溶液的作用是(用离子方程式表示)__________________________________。
-
丁烷的催化裂解可按下列两种方式进行:C4H10→C2H6+C2H4; C4H10→CH4+C3H6;某化学兴趣小组的同学为探究丁烷裂解气中CH4和C2H6的比例关系,设计如图所示实验:
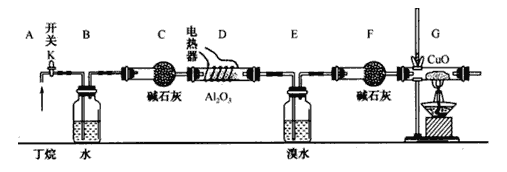
注:CuO能将烃氧化成CO2和H2O;A12O3是丁烷裂解的催化剂,G后面装置已省略。如图连接好装置后(部分夹持装置已略去),需进行的实验操作有:
①给D、G装置加热:②检査整套装置的气密性;③排尽装置中的空气。
(1)这三步操作的先后顺序依次是____________。
(2)简要说明检验空气排尽的方法:_______________________________________________。
(3)B装置所起的作用是__________________________________________。
(4)假设丁烷完全裂解,流经各装置中的气体能完全反应。当(E和F)装置的总质量比反应前增加了 1.82g, G装置中固体质量减少了 4.l6g,则丁烷的裂解产物中n(CH4)∶n(C2H6)=_____________。
(5)若对E装置中的混合物再按以下流程实验:

①分离操作I、Ⅱ的名称是I_____________、 II_______________;
②Na2SO3溶液的作用是(用离子方程式表示)__________________________________。
-
石油化工生产中,通过裂解可获得化工产品如乙烯、丙烯等。在2L恒温密闭容器中投入10mol丁烷(C4H10),在一定条件下发生反应:(C4H10(g)  C2H4(g)+C2H6(g)。测得体系中乙烯的物质的量与时间关系如图所示:
C2H4(g)+C2H6(g)。测得体系中乙烯的物质的量与时间关系如图所示:
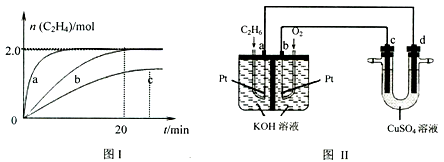
(1)能判断反应达到化学平衡状态的是 (填字母)。
A.c(C2H6)与c(C2H4)的比值保持不变
B.容器中气体压强保持不变
C.容器中气体密度保持不变
D.单位时间内有1molC4H10消耗的同时有1molC2H4生成
(2)相对于曲线b,曲线a改变的条件是 ,判断的理由是 。
(3)若图中b、c表示其它条件不变,改变温度时n(C2H4)随时间的变化曲线,可以判断该反应的正反应是 (填“放热”或“吸热”反应)。
(4)在曲线b对应的条件下,反应进行0~20min区间内的速率v(C2H6)= 。
(5)将C2H6和O2设计成如图Ⅱ电化学装置,若c、d均用铜电极,a极的电极反应式为 ;c极的电极反应式为 。
-
丁烯(C4H8)是制备线性低密度聚乙烯(LLDPE)的原料之一,可由丁烷(C4H10)催化脱氢制备,C4H10(g) C4H8(g)+H2(g)
C4H8(g)+H2(g)  H=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[
H=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[ ]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
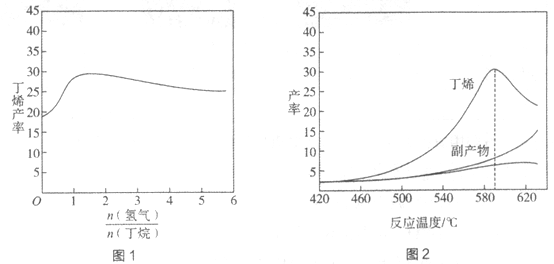
下列分析正确的是
A. 氢气的作用是活化固体催化剂,改变氢气量不会影响丁烯的产率
B. 丁烷催化脱氢是吸热反应,丁烯的产率随温度升高而不断增大
C. 随温度升高丁烯裂解生成的副产物增多,会影响丁烯的产率
D. 一定温度下,控制进料比[ ]越小,越有利于提高丁烯的产率
]越小,越有利于提高丁烯的产率
-
丁烯(C4H8)是制备线性低密度聚乙烯(LLDPE)的原料之一,可由丁烷(C4H10)催化脱氢制备,C4H10(g) C4H8(g)+H2(g)
C4H8(g)+H2(g)  H=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[
H=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[ ]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
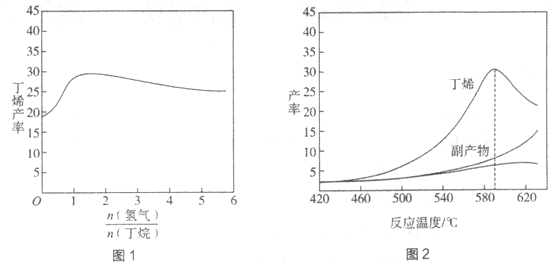
下列分析正确的是
A. 氢气的作用是活化固体催化剂,改变氢气量不会影响丁烯的产率
B. 丁烷催化脱氢是吸热反应,丁烯的产率随温度升高而不断增大
C. 随温度升高丁烯裂解生成的副产物增多,会影响丁烯的产率
D. 一定温度下,控制进料比[ ]越小,越有利于提高丁烯的产率
]越小,越有利于提高丁烯的产率
-
苯乙烯( )是合成橡胶和塑料的重要单体,也是生产某些药物、农药的中间体。化合物E是一种昆虫信息素,可以通过以下流程制备。
)是合成橡胶和塑料的重要单体,也是生产某些药物、农药的中间体。化合物E是一种昆虫信息素,可以通过以下流程制备。

完成下列填空:
(1)反应②的反应类型__________;上述流程中的物质,与B互为同分异构体是__________。写出B的属于芳香烃的一种同分异构体的结构简式__________,该物质的名称为_________。
(2)反应①中,A和苯按摩尔比1:1完全反应,产物只有B。写出A的结构简式___________。
(3)写出反应③的化学方程式____________________________________。
(4)以B为原料制取C的反应是可逆反应,分离C、B混合物的实验操作为____________。
(5)苯乙烯露置于空气中可被氧化为苯甲醛和甲醛。设计实验方案检验苯乙烯样品是否被氧化变质______________________________________。
(6)参照上述合成路线的表示方法,设计以苯乙烯为原料经过三步反应制备新型高分子导电材料PPA( )的合成路线,并注明必要的反应条件。(无机物任选)_____________
)的合成路线,并注明必要的反应条件。(无机物任选)_____________
-
食品安全关系国计民生,影响食品安全的因素很多.下面是以食品为主题的相关问题,请根据要求回答.
聚偏二氯乙烯( )具有超强阻隔性能,可作为保鲜食品的包装材料.它
)具有超强阻隔性能,可作为保鲜食品的包装材料.它
是由________(写结构简式)单体发生加聚反应生成的.若以乙炔为原料,通过加成反应生成1,1,2三氯乙烷,再和氢氧化钠醇溶液反应可合成这种单体,则在上述加成反应中宜选择的加成试剂是________.(选填编号字母)
A.HCl B.Cl2
C.HClO D.NaCl
C2H4(g)+C2H6(g) △H1
CH4(g)+C3H6(g) △H2











