-
某温度时,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)经过5min后,反应达到平衡,此时转移电子6mol。该反应的平衡常数为_______。V(H2)=_____mol/(L·min)。若保持体积不变,再充入2mulCO和1.5mol CH3OH,此时v(正)___ v(逆)(填“>”“<”或“=”)。
(2)在其他条件不变的情况下,再增加2molCO与5molH2,达到新平衡时,CO的转化率____(填“增大”“减小”或“不变”)。
(3)下列不能说明该反应已达到平衡状态的是__________
a.CH3OH 的质量不变 b.混合气体的平均相对分子质量不再改变
c.V逆(CO)=2V正(H2) d.混合气体的密度不再发生改变
(4)在一定压强下,容积为VL的容器充入a molCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
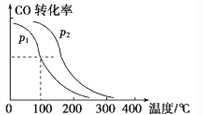
则p1_____p2(填“大于”“小于” 或“等于”,下同),△H_____0。该反应在_______( 填“高温” 或“低温” )下能自发进行。
(5)能使该反应的反应速率增大,且平衡向正反应方向移动的是_____。
a.及时分离除CH3OH气体 b.适当升高温度
c.增大H2的浓度 d.选择高效催化剂
(6)下面四个选项是四位学生在学习化学反应速率与化学反应限度以后,联系化工生产实际所发表的看法,你认为不正确的是_______。
a.化学反应速率理论可指导怎样在一定时间内快出产品
b.有效碰撞理论可指导怎样提高原料的转化率
c.勒夏特列原理可指导怎样使用有限原料多出产品
d.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
-
(14分)某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g) CH3OH(g)。经过5min后,反应达到平衡,此时转移电子6mol。
CH3OH(g)。经过5min后,反应达到平衡,此时转移电子6mol。
(1)该反应的平衡常数为 ,v(CH3OH)= mol·L-1·min-1。若保持体积不变,再充入2molCO和1.5molCH3OH,此时v正_______v逆(填“>”、“<”或“=”)。
(2)在其它条件不变的情况下,再增加2molCO与5molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(3)下列不能说明该反应已达到平衡状态的是 。
a.CH3OH的质量保持不变 b.混合气体的平均相对分子质量不再改变
c.v逆(CO)=2v正(H2) d.混合气体的密度不再发生改变
(4)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。则p1________p2(填“大于”、“小于”或“等于”,下同),△H________0,该反应在(填“高温”或“低温”)下能自发进行。
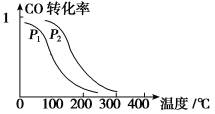
(5)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除CH3OH气体 b.适当升高温度
c.增大H2的浓度 d.选择高效催化剂
-
在一个容积为500毫升的密闭容器中,充入5molH2和2molCO,在一定温度和一定压强下发生如下反应:2H2(g )+CO(g)  CH3OH(g),经过5分钟后达到平衡状态,若此时测得CH3OH蒸汽的浓度为2mol/L,求:
CH3OH(g),经过5分钟后达到平衡状态,若此时测得CH3OH蒸汽的浓度为2mol/L,求:
(1)以H2的浓度变化表示的该反应的速率;
(2)达到平衡时CO的转化率;
(3)该温度下的K
-
在①、②、③容积不等的恒容密闭容器中,均充入0.1molCO和0.2molH2,在催化剂的作用下发生反应:CO(g)+2H2(g) CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:下列说法正确的是( )
CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:下列说法正确的是( )
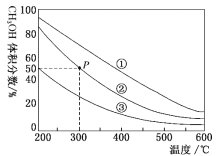
A.该反应的正反应为吸热反应
B.三个容器容积:①>②>③
C.在P点,CO转化率为75%
D.在P点,向容器②中再充入CO、H2及CH3OH各0.025mol,此时v(CO)正>v(CO)逆
-
CO与H2在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。
CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。
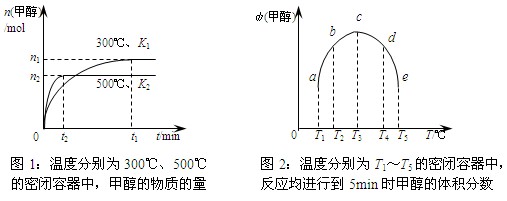
下列有关说法正确的是
A.该反应的正反应是气体体积减小的吸热反应
B.K1<K2 (K为该条件下反应的平衡常数)
C.反应进行到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动
D.将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压
-
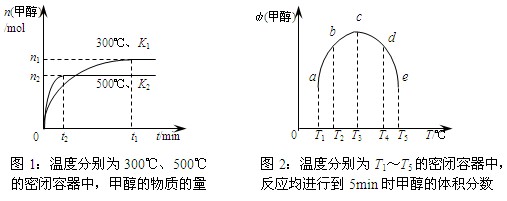
CO与H2在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。
CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。
下列有关说法正确的是
A.该反应的正反应是气体体积减小的吸热反应
B.K1<K2 (K为该条件下反应的平衡常数)
C.反应进行到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动
D.将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压
-
CO与H2在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g)⇌CH3OH(g).在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温.实验测得相关数据如下图1和图2.
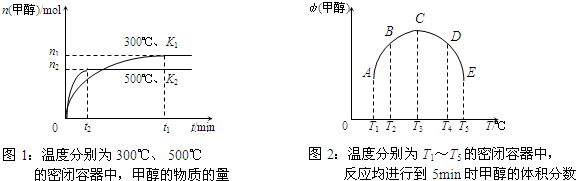
下列有关说法正确的是( )
A.该反应的正反应是气体体积减小的吸热反应
B.K1<K2(K为该条件下反应的平衡常数)
C.反应进行到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动
D.将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压
-
CO与H2在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。
CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。
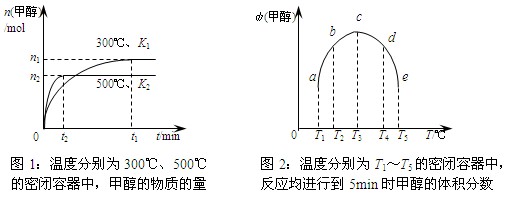
下列有关说法正确的是
A.该反应的正反应是气体体积减小的吸热反应
B.K1<K2 (K为该条件下反应的平衡常数)
C.反应进行到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动
D.将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压
-
CO与H2在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g)⇌CH3OH(g).在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温.实验测得相关数据如下图1和图2.
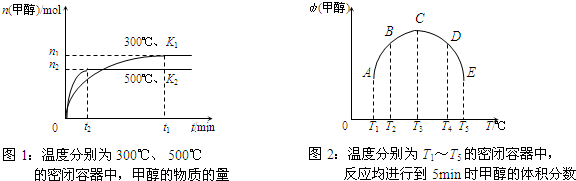
下列有关说法正确的是( )
A.该反应的正反应是气体体积减小的吸热反应
B.K1<K2(K为该条件下反应的平衡常数)
C.反应进行到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动
D.将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压
-
在①、②、③容积不等的恒容密闭容器中,均充入0.lmolCO和0.2molH2,在催化剂的作用下发生反应:CO(g)+2H2(g)  CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:
CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:
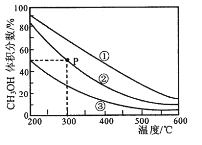
下列说法正确的是
A. 该反应的正反应为放热反应
B. 三个容器容积:①>②>③
C. 在P点,CO转化率为75%
D. 在P点,向容器②中再充入CO、H2 及 CH3OH 各 0.025mol,此时 v(CO)正<v (CO)逆
CH3OH(g)。








