-
工业上需要利用一批回收的含铜废料制造胆矾(CuSO4·5H2O)。该废料中各种成份含量如下:Cu和CuO约占87%,其它为Mg、Al、Fe、Si及其氧化物,还有少量的难溶物质。工艺流程为:
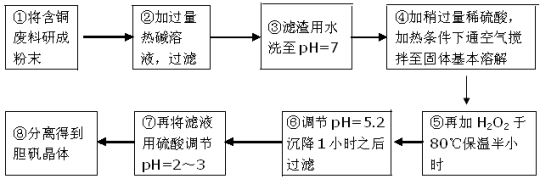
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
请回答下列问题:
(1)步骤①中为什么要将含铜废料研磨成粉状? 。
(2)步骤②中的离子方程式(写出2个即可):
、
。
(3)步骤⑤中H2O2参加反应的离子方程式: 。
(4)步骤⑥中调节溶液pH时适宜的物质是 (填序号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
(5)步骤⑦中用硫酸调节pH=2~3的原因是 。
(6)步骤⑧的分离方法步骤是 。
-
某化学兴趣小组用只含有Al、Fe、Cu的工业废料制取氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),以探索工业废料的再利用。其实验方案如下:
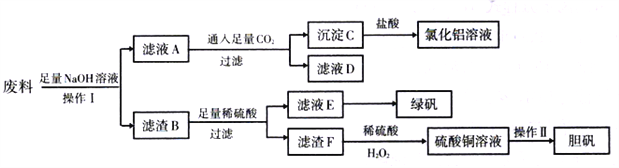
(1)操作I应选择以下装置中的_____________(填正确答案编号)。
(2)滤液D中的溶质主要是________________(写化学式)。
(3)写出沉淀C与盐酸反应的离子方程式:________________。
(4)滤液E露置在空气中一段时间后,检测出溶液中含Fe2+,原因是________________。
(5)写出滤渣F与稀硫酸、H2O2制硫酸铜的反应方程式_______________________,该反应与滤渣F跟浓硫酸直接反应相比,其优点是_________________________________。
(6)操作II步骤有蒸发浓缩、_______________、过滤洗涤、自然干燥。
-
胆矾(CuSO4·5H2O)是铜的重要化合物,在工业生产中应用广泛。实验室制备胆矾的流程如下:

(1) 稀硫酸、稀硝酸与铜粉反应生成一种无色气体,该气体是_____(写化学式),制得的胆矾晶体中可能存在的杂质是_____(写名称)。
(2) 实验室可采用沉淀法测定所得胆矾晶体中CuSO4·5H2O的含量,步骤如下:
①取样、称量;②加水充分溶解;③加入BaCl2溶液;④过滤、洗涤、干燥;⑤称量、计算。在过滤前,需要检验SO42-是否沉淀完全,检验方法是____________________________________________
(3) 若改变反应条件可获得化学式为Cux(OH)y(SO4)z·nH2O的晶体,用热重分析仪对Cux(OH)y(SO4)z·nH2O晶体进行分析并推断该晶体的化学式。取3.30 g晶体样品进行热重分析,所得固体质量的变化曲线如下图所示。已知:体系温度在650 ℃及以下时,放出的气体只有水蒸气;实验测得温度在650 ℃时,残留固体的组成可视为aCuO·bCuSO4;温度在1 000 ℃以上时,得到的固体为Cu2O。
请回答下列问题:
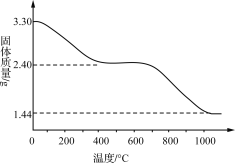
①温度650~1 000 ℃产生的气体中,n(O)∶n(S)____(填“>”“<”或“=”)3。
②通过计算推断Cux(OH)y(SO4)z·nH2O晶体的化学式:__________。
-
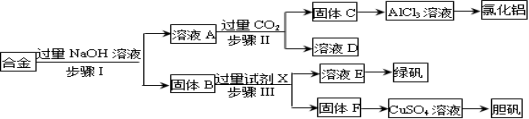
为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取无水氯化铝、绿矾晶体(FeSO4•7H2O)和胆矾晶体。
请回答:
【制备无水氯化铝】
(1)步骤Ⅰ进行的实验操作所需要的玻璃仪器是 ;
(2)步骤Ⅱ生成固体C的离子方程式是 ;
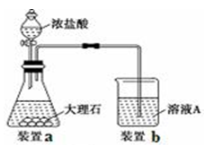
(3)进行步骤Ⅱ时,该小组用如下图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 ;
(4)由AlCl3溶液制备无水AlCl3的实验过程如下:
①由AlCl3溶液制备氯化铝晶体(AlCl3•6H2O)涉及的操作为: 、冷却结晶、过滤、洗涤;
②将AlCl3•6H2O溶于浓硫酸进行蒸馏,可以得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的 (填字母)。
a.氧化性 b.吸水性 c.难挥发性 d.脱水性
【制备胆矾晶体】
(5)用固体F制备CuSO4溶液,可设计以下三种途径,你认为的最佳途径为 。(填序号)

【测定FeSO4•7H2O含量】
(6)称取制得的绿矾样品10.0 g,溶于适量的稀硫酸中,配成100 mL溶液,准确量取2 5.00 mL该液体于锥形瓶中,再用0.1000 mol/L KMnO4标准溶液滴定。用同样的方法滴定3次,平均消耗15.00 mL标准液,则样品中FeSO4•7H2O的质量分数为 。(已知Mr(FeSO4·7H2O)=278)
5.00 mL该液体于锥形瓶中,再用0.1000 mol/L KMnO4标准溶液滴定。用同样的方法滴定3次,平均消耗15.00 mL标准液,则样品中FeSO4•7H2O的质量分数为 。(已知Mr(FeSO4·7H2O)=278)
-
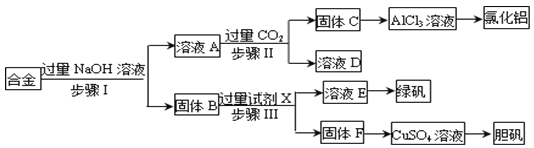
为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)写出步骤Ⅰ反应的离子方程式:_________________________。
(2)试剂X是______。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是________。
(3)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式_______________________________,请选出你认为的最佳途径并说明选择的理由______________________________。
-
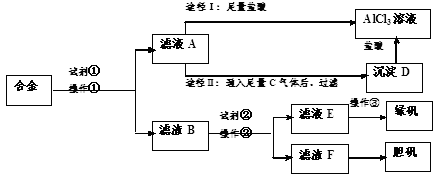
某工厂有废合金(含有铝、铁、铜)粉末,甲同学探索工业废料的利用,用该废合金粉末制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,其实验方案如下:
试回答下列问题:
(1)所加试剂①、②分别是 、 。
(2)操作①的名称为 ,所用的仪器除铁架台、铁圈和烧杯,还需要的器材有 。
(3)由滤液A制AlCl3溶液有途径Ⅰ和途径Ⅱ两种,你认为合理的是__________,理由________________;
写出A→D反应离子方程式:____________________________。
(4)操作③的名称是_________________。
(5)丙同学提出可将方案中最初溶解合金的试剂①改为盐酸,重新设计方案,也能得到三种物质,你认为后者的方案比原方案是否更合理: ,理由是 。
-
(10分)工业上可以利用含铝、铁、铜合金的废料获得绿矾(FeSO4·7H2O)、胆矾等,甲同学设计的实验方案如下:
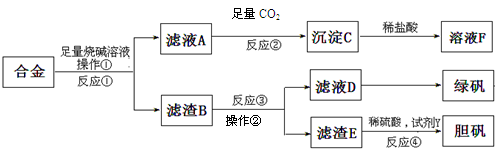
请回答:
(1)操作①、操作②所用的玻璃仪器是 ;沉淀C的化学式为 。
(2)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选): 。
(3)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是 。
(4)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和H2O2制胆矾晶体,则反应④的离子化学方程式为 。
-
实验室中需要0.2mol/L的CuSO4溶液950mL, 配制时应选用的容量瓶的规格和称取胆矾(CuSO4·5H2O) 的质量分别是
A.950mL 30.4g B.950mL 47.5g C.1000mL 50.0g D.1000mL 32.0g
-
胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
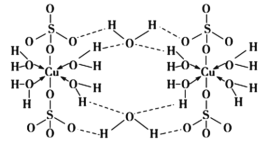
下列有关胆矾的说法不正确的是
A.胆矾中有轨道杂化的氧原子和硫原子杂化方式为sp3
B.胆矾中含有的作用力有离子键、极性共价键、配位键、氢键
C.Cu2+价电子排布式为3d84s1
D.胆矾的结晶水在不同温度下会分步失去
-
胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
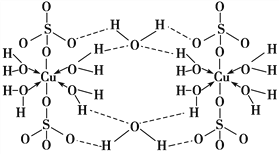
下列有关胆矾的说法正确的是( )
A. 所有氧原子都采取sp3杂化 B. 氧原子参与形成配位键和氢键两种化学键
C. Cu2+的价电子排布式为3d84s1 D. 胆矾中的水在不同温度下会分步失去













