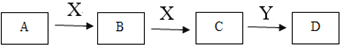-
近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx、挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g) 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g) CO2(g)+2H2O(g)+N2 (g) △H=_____;
CO2(g)+2H2O(g)+N2 (g) △H=_____;
(2)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
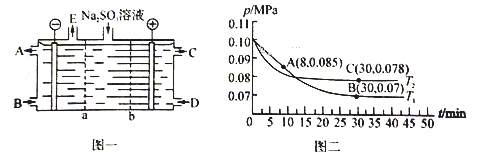
① b表示_____离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品。其中C为硫酸,则A表示______________。
②阳极的电极反应式为______________________________________。
(3)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g) 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2〔其中n(SO2):n(O2)=1:1〕,测得容器内总压强与反应时间如图二所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2〔其中n(SO2):n(O2)=1:1〕,测得容器内总压强与反应时间如图二所示。
①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率v0(正)与A点的逆反应速率vA(逆)的大小关系为vA(逆)_____ v0(正) (填“>” “<”或“ = ”)。
-
研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:NO NO2
NO2 N2
N2
已知:NO(g)+O3(g)===NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1
2NO(g)+O2(g)===2NO2(g) ΔH=-116.2 kJ·mol-1
则反应Ⅰ的热化学方程式为___________________________________________________________。
(2)有人设想将CO按下列反应除去:2CO(g)===2C(s)+O2(g) ΔH>0,请你分析该设想能否实现?________(填“能”或“否”),依据是_________________________________________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka=1.70×10-4。
①甲酸钠的水溶液呈碱性,请用离子方程式表示其原因________________________________________。
②向20 mL 0.1 mol·L-1的甲酸钠溶液中滴加10 mL 0.1 mol·L-1的盐酸,混合液呈________(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为_________________________________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.100 0 mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
| 温度 | 固体活性炭/mol | NO/mol | A/mol | B/mol |
| 200 ℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
| 335 ℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为________(填“吸热”或“放热”)反应。
②200 ℃时,平衡后向恒容容器中再充入0.1 mol NO,再次平衡后,NO的百分含量将________(填“增大”“减小”或“不变”)。
③计算反应在335 ℃时的平衡常数为________。
-
研究碳、氮、硫及其化合物的转化对环境的改善有重大意义。
(1)在一定条件下, CH4 可与 NO2 反应除去 NO,已知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= 890.2 kJ•mol-1
②2NO2(g) ⇌ N2(g)+ 2O2 (g) ΔH =-67.0 kJ•rnol-1
③H2O (g)= H2O(l) ΔH =-44.0 kJ•mol-1
则 CH4(g)+ 2NO2 (g) ⇌ CO2(g)+ 2H2O(g)+N2(g) ΔH = ___ kJ·mol-1 。
(2)SO2 经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2 SO2 (g)+O2(g) ⇌ 2SO3(g) ΔH <0,下列说法正确的是______。
A.升高温度,正反应速率增大,逆反应速率减小
B.使用催化剂, 能提高SO2 的转化率
C.在一定温度下的恒容容器中,混合气体的密度不再发生变化能说明上述反应达到平衡状态
D.温度不变,增大压强, 该反应的化学平衡常数不变
E.350K 和 500K 时,反应的平衡常数分别为Kl、K2,且K1>K2
(3)若在 T1℃下,往一恒容密闭容器中通入SO2 和 O2[其中n (SO2)∶n(O2)=2∶l]发生反应2 SO2 (g)+O2(g) ⇌ 2SO3(g),容器中总压强为 0.1 MPa,反应 8min 时达到平衡,测得容器内总压强为0.09MPa,反应 8min 时,SO2 的转化率为 _________ 。
(4)将 NO2、O2和熔融KNO3 制成燃料电池,电解处理含Cr2O 的废水,工作原理如图所示。
的废水,工作原理如图所示。
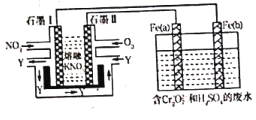
①Fe(a)电极为 ____________(填“阳极”或“阴极”),a 极的电极反应为________。
②请完成电解池中Cr2O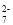 转化为Cr3+的离子反应方程式:Cr2O
转化为Cr3+的离子反应方程式:Cr2O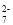 + ___Fe2+ __=___Cr3+ __Fe3+__。
+ ___Fe2+ __=___Cr3+ __Fe3+__。
③若在标准状况下有 224 mL 氧气参加反应,则电解装置中铁棒的质量减少 ____。在相同条件下,消耗的NO2和O2的体积比为_________。
④称取含 Na2Cr2O7 的废水样品6.55g配成 250mL溶液,量取 25.00mL 于碘量瓶中,加入2mol • L-1 H2SO4和足量碘化钾溶液(铬的还原产物为Cr3+),放于暗处 5min,加入淀粉溶液作指示剂,用0.3000mol • L-1Na2S2O3]标准溶液滴定 (I2 +2S2O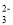 =2 I- + S4O
=2 I- + S4O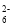 ),判断达到滴定终点的现象是______。若实验中平均消耗Na2S2O3 标准溶液 25.00mL,则重铬酸钠的纯度为 ______(设整个过程中其他杂质不参与反应)。
),判断达到滴定终点的现象是______。若实验中平均消耗Na2S2O3 标准溶液 25.00mL,则重铬酸钠的纯度为 ______(设整个过程中其他杂质不参与反应)。
(5)为了清除 NO、NO2、N2O4对大气的污染, 常采用氢氧化钠溶液进行吸收处理。现有由 a mol NO2、b mol N2O4,cmolNO组成的混合气体,恰好被VL氢氧化钠溶液吸收(无气体剩余)转化为 NaNO3和NaNO2,则此氢氧化钠溶液的物质的量浓度最小为_________。
-
氮及其化合物在工农业生产、生活中有着重要应用。
(1)烟气中的氮氧化物(NOx)可与甲烷在一定条件下反应转化为无害成分,从而消除污染。已知
| 反应 | 反应热(△H/kJ·mol-1) | 平衡常数(K) |
| CH4(g)+2O2(g)═CO2(g)+2H2O(l) | a | K1 |
| N2(g)+O2(g)═2NO(g) | b | K2 |
则 CH4 脱硝的热化学方程式为 CH4 (g) + 4NO (g)⇌CO2 (g) + 2N2 (g) + 2H2O ΔH=_________kJ/mol(用 a、b 表示);平衡常数 K3=_________(用 K1、K2 表示)。
(2)用活性炭还原法可以消除NO 的污染,发生的反应为C(s)+2NO(g)⇌N2(g)+CO2(g)。1molNO 和足量的活性炭在T℃、容积恒定为2L的密闭容器中反应,经过5min反应达到平衡,测得NO的物质的量为0.4mol。
①从反应开始到5min,用氮气表示的平均反应速率为_________。达到平衡后,向容器中再通入0.1molNO气体和0.3molCO2气体,则此平衡将_________(填“正向移动”“不移动”或“逆向移动”)。
②能判断该反应一定达到化学平衡状态的依据是_________(填标号)。
a.NO和N2的体积比保持不变
b.单位时间内生成2nmolNO的同时消耗nmolCO2
c.恒温恒容条件下,反应体系的压强不再发生改变
d.恒容条件下,混合气体的平均相对分子质量不变
(3)某实验小组模拟4CO(g)+2NO2(g) ⇌4CO2(g)+N2(g) ΔH=-1200kJ·mol-1净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,则该反应的平衡常数为__________;两种方式达平衡时,N2的体积分数:甲______乙(填“>、=、<或不确定”)
| 甲 | 乙 |
| 0.2molNO2 | 0.1molNO2 |
| 0.4molCO | 0.2molCO |
-
某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,绘制出如下转化关系图(部分反应物或产物略去),并用于研究物质A、B、C、D的性质及其变化。
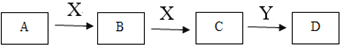
(1)若A是黄绿色气体,X是生活中应用最大量的金属,D是白色固体。
① 组成A的元素在周期表中的位置是______。
② 下列说法正确的是______(填字母)。
a.B的水溶液中加入KSCN溶液,变为红色
b.C只具有还原性
c.若Y是碱,D放置在空气中会迅速变为灰绿色,最终变为红褐色
(2)若A、B、C、D的焰色反应均为黄色,X的固体俗称干冰。
① B转化为C的离子方程式是______。
② A用于呼吸面具或潜水艇中氧气的来源,则A和X反应生成1 mol B时,转移电子数为______。
③ C与Y反应生成X的离子方程式_________________。
-
某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,绘制出如下转化关系图(部分反应物或产物略去),并用于研究物质A、B、C、D的性质及其变化。
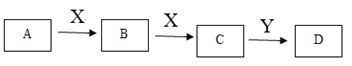
(1)若A是黄绿色气体,X是生活中应用最大量的金属,D是白色固体。
① 组成A的元素在周期表中的位置是______。
② 下列说法正确的是______(填字母)。
a.C只具有还原性
b.B的水溶液中加入KSCN溶液,变为红色
c.若Y是碱,D放置在空气中会迅速变为灰绿色,最终变为红褐色
(2)若A、B、C、D的焰色反应均为黄色,X的固体俗称干冰。
① B转化为C的化学方程式是______。
② A用于呼吸面具或潜水艇中氧气的来源,则A和X反应生成1 mol B时,转移电子的物质的量为______ mol。
-
(14分)氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式________。(2分)

(2)已知:
N2(g)+O2(g)=2 NO(g) △H=+180 kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-746 kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H=________kJ·mol-1 (2分)
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应。N2(g)+3H2(g) 2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2mol,则前5分钟的平均反应速率v(N2)为________,平衡时H2的转化率为________,该反应的平衡常数K=________。(6分)
2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2mol,则前5分钟的平均反应速率v(N2)为________,平衡时H2的转化率为________,该反应的平衡常数K=________。(6分)
(4)在固定体积的密闭容器中,1.0×103kPa时,反应N2(g)+3H2(g) 2NH3(g) △H<0的平衡常数K与温度T的关系如下表:
2NH3(g) △H<0的平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
则K1________K2(填写“>”、“=”或“<”)(2分)
(5)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是________
(填字母)(2分)
a. 容器内N2、H2、NH3的浓度之比为1:3:2 b. NH3的浓度保持不变
c. 容器内压强保持不变 d.. 混合气体的密度保持不变
-
(12分))氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。(1)上图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式。
(2)已知:N2(g)+ O2(g)= 2 NO(g) △H = +180 kJ • mol-1
2NO(g)+2 CO(g)= N2(g) + 2 CO2(g) △H = - 746 kJ • mol-1
则反应CO(g) + O2(g) = CO2(g)的 △H = ________ kJ • mol-1
O2(g) = CO2(g)的 △H = ________ kJ • mol-1
(3)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为________,该反应的平衡常数表达式K =________。
2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为________,该反应的平衡常数表达式K =________。
(4) 在固定体积的密闭容器中,1.0×103 kPa时反应 N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H<0 的平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
①K1________K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是________(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.NH3的浓度保持不变
c.容器内压强保持不变 d.混合气体的密度保持不变
-
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
I.已知:NO2(g)+SO2(g)  SO3(g)+NO(g)
SO3(g)+NO(g)
(1)一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO2和NO2的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
e.气体密度保持不变
(2)若保持体积不变,升高温度,体系颜色加深,则说明该反应的∆H________0(填”>””<”或”=”)
II.对于反应2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6kJ/mol。
2SO3(g);ΔH=-196.6kJ/mol。
在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
(3 )加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 。
)加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 。
(4)保持同一温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,欲使起始时反应表现为向正反应方向进行,且平衡时SO3的体积分数为2/9,a的取值范围是 。
(5)保持同一温度,在相同容器中,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,则平衡_________移动。(填“正向、不、逆向或无法确定是否”)
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中SO3的含量最高的一段时间是____________。
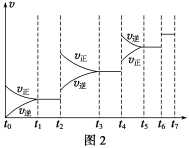
(7)各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
K1、K2、K3、K4之间的关系为__________________。
-
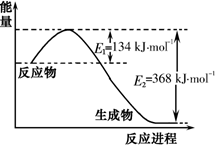
(9分)氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式________。
(2)已知:N2(g)+ O2(g)= 2 NO(g) △H = +180 kJ • mol-1
2NO(g)+2 CO(g)= N2(g) + 2 CO2(g) △H = - 746 kJ • mol-1
则反应CO(g) + O2(g) = CO2(g)的 △H = ________ kJ • mol-1
O2(g) = CO2(g)的 △H = ________ kJ • mol-1
(3)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为________,该反应的平衡常数表达式K =________。
2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为________,该反应的平衡常数表达式K =________。
(4) 在固定体积的密闭容器中,1.0×103 kPa时反应 N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H<0 的平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
①K1________K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是________(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.NH3的浓度保持不变
c.容器内压强保持不变 d.混合气体的密度保持不变
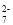 的废水,工作原理如图所示。
的废水,工作原理如图所示。
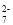 转化为Cr3+的离子反应方程式:Cr2O
转化为Cr3+的离子反应方程式:Cr2O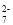 + ___Fe2+ __=___Cr3+ __Fe3+__。
+ ___Fe2+ __=___Cr3+ __Fe3+__。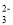 =2 I- + S4O
=2 I- + S4O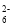 ),判断达到滴定终点的现象是______。若实验中平均消耗Na2S2O3 标准溶液 25.00mL,则重铬酸钠的纯度为 ______(设整个过程中其他杂质不参与反应)。
),判断达到滴定终点的现象是______。若实验中平均消耗Na2S2O3 标准溶液 25.00mL,则重铬酸钠的纯度为 ______(设整个过程中其他杂质不参与反应)。