-
A、B、C、D 为原子序数依次增大的四种元素,A2−和 B+具有相同的电子构型;C、D 为同周期元素,C 核外电子总数是最外层电子数的 3 倍;D 元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_____(填元素符号),其中 C 原子的外围电子排布图为_____.
(2)单质 A 有两种同素异形体,其中沸点高的是_________(填分子式),原因是_____;A 和 B 的氢化 物所含的化学键类型分别为_____和_____.
(3)C 和 D 反应可生成组成比为 1:3 的化合物 E,E 的立体构型为_____,中心原子的杂化轨 道类型为_____.
(4)化合物 D2A 的立体构型为_____,中心原子的价层电子对数为_____,单质 D与湿润的 Na2CO3 反应可制备 D2A,其化学方程式为_____。
-
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、 D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______(填元素符号),其中C原子的核外电子排布式为__________,A元素在元素周期表中的位置是__________,B原子的结构示意图为__________,A、B、C、D四种元素的离子半径从大到小的顺序是__________(用离子符号表示)。
(2)单质A有两种同素异形体,其中沸点高的是_____(填分子式),原因是_______;A和B的氢化物所属的晶体类型分别为______和______。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为___,中心原子的杂化轨道类型为___。
(4)化合物D2A的立体构型为___,中心原子的价层电子对数为______
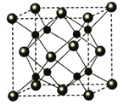
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F的化学式为_____:晶胞中A 原子的配位数为______;列出晶体F的密度(g.cm-3)计算式_____。
-
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最小的是________(填元素符号),其中C原子的外围电子排布图为________。
(2)A和B的氢化物所属的晶体类型分别为_________和_________。
(3)B、C均可以与D形成化合物,其中熔点较高的是____(用化学式表示)
(4)A和B可形成1:1型的化合物E,E的电子式为_____
(5)化合物D2A的立体构型为_________,中心原子的孤电子对数为_________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_______________。
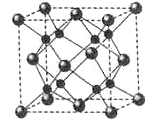
(6)A和B能够形成化合物F,其晶胞结构如图所示,晶胞边长为0.566nm, F 的化学式为______;晶胞中A 原子的配位数为______;晶体F的密度=______g.cm-3(只列式,不计算)
-
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布布式为 。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
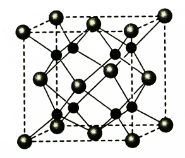
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
-
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______(填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是_____(填分子式),原因是_______;A和B的氢化物所属的晶体类型分别为______和______。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为______,中心原子的杂化轨道类型为______。
(4)化合物D2A的立体构型为___,中心原子的价层电子对数为______,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_________。
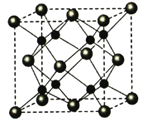
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为______:晶胞中A 原子的配位数为_________;列式计算晶体F的密度(g.cm-3)_____。
-
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______(填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是_____(填分子式),原因是_______;
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为______,中心原子的杂化轨道类型为______。
(4)化合物D2A的立体构型为___,中心原子的价层电子对数为______,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_________。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,晶胞中A 原子的配位数为_________;列式计算晶体F的密度(g.cm-3)_____。
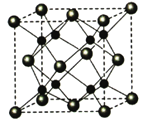
-
[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
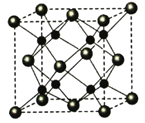
-
[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
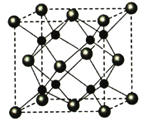
-
A、B、C、D、E、F为前四周期元素,原子序数依次增大,A、D同主族,A2—和B+具有相同的电子层结构;C、E为同周期元素,C核外电子总数是最外层电子数的3倍;E元素最外层有一个未成对电子;F的最外层只有1个电子,但次外层有18个电子。
请回答下列问题:
(1)基态F原子的核外电子排布式为______,F元素在周期表中的位置______,F2+能与足量氨水反应得到深蓝色透明溶液,该深蓝色离子的结构式为______。
(2)六种元素中电负性最小的是______,其中C、D、E的第一电离能由大到小的顺序为______(填元素符号)。
(3)A、D的简单氢化物中沸点较高的物质是______(填化学式),原因是______。
(4)C和E的单质反应可生成组成比为1:3的化合物,该化合物的立体构型名称为 ______,中心原子的杂化轨道类型为______。
-
A、B、C、D、E、F为前四周期元素,原子序数依次增大,A、D同主族,A2—和B+具有相同的电子层结构;C、E为同周期元素,C核外电子总数是最外层电子数的3倍;E元素最外层有一个未成对电子;F的最外层只有1个电子,但次外层有18个电子。
请回答下列问题:
(1)基态F原子的核外电子排布式为______,F元素在周期表中的位置______,F2+能与足量氨水反应得到深蓝色透明溶液,该深蓝色离子的结构式为______。
(2)六种元素中电负性最小的是______,其中C、D、E的第一电离能由大到小的顺序为______(填元素符号)。
(3)A、D的简单氢化物中沸点较高的物质是______(填化学式),原因是______。
(4)C和E的单质反应可生成组成比为1:3的化合物,该化合物的立体构型名称为 ______,中心原子的杂化轨道类型为______。






