-
氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l)△H=-97.3kJ/mol
SO2Cl2(l)△H=-97.3kJ/mol
(1)若在此条件下,将化学平衡常数K减小,化学反应速率v正增大,可采取的措施是___(选填编号)。
a.升高温度 b.移走SO2Cl2 c.增加反应物浓度 d.无法满足上述条件
(2)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是___(选填编号)。
a.缩小容器体积 b.使用催化剂 c.增加SO2浓度 d.升高温度
(3)在100℃时,往上述平衡体系中加入37Cl2,一段时间后,则平衡体系中含有37Cl的物质有___(选填编号)。
a.只有37Cl2 b.只有SO237Cl2 c.37Cl2和SO237Cl2 d.无法判断
(4)下列描述中能说明上述反应已达平衡状态的是____(选填编号)。
a.υ(Cl2)= υ(SO2) b.容器中气体压强不随时间而变化
c.c(Cl2) :c(SO2)=1 :1 d.容器中气体颜色不随时间而变化
(5)300℃时,体积为1L的密闭容器中充入16g SO2Cl2,达到平衡时容器中含SO2 7g。若在上述的平衡体系中,再加入16g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是__。
-
氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点-54.1 ℃,沸点69.1 ℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g) SO2Cl2(l) ΔH=-97.3 kJ/mol
SO2Cl2(l) ΔH=-97.3 kJ/mol
(1)试写出常温常压下化学平衡常数K的表达式:K=_____________;
若在此条件下,将化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是________(选填编号)。
a.降低温度 b.移走SO2Cl2
c.增加反应物浓度 d.以上都不对
(2)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是________(选填编号)。
a.缩小容器体积 b.使用催化剂
c.增加SO2浓度 d.升高温度
(3)在100 ℃时,往上述平衡体系中加入37Cl2,一段时间后,则平衡体系中含有37Cl的物质有________(选填编号)。
a.只有37Cl2 b.只有SO Cl2 c.37Cl2和SO
Cl2 c.37Cl2和SO Cl2 d.无法判断
Cl2 d.无法判断
(4)下列描述中能说明上述反应已达平衡的是________(选填编号)。
a.v(Cl2)=v(SO2)
b.容器中气体压强不随时间而变化
c.c(Cl2)∶c(SO2)=1∶1
d.容器中气体颜色不随时间而变化
-
磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。
(1)已知:SO2(g) +Cl2(g)+ SCl2(g) 2SOCl2(g) △H=a kJ·mol-1
2SOCl2(g) △H=a kJ·mol-1
SO2Cl2(g)+ SCl2(g) 2SOCl2(g) △H=b kJ·mol-1
2SOCl2(g) △H=b kJ·mol-1
则反应:SO2(g) + Cl2(g) SO2Cl2(g) △H =______kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K =______。
SO2Cl2(g) △H =______kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K =______。
(2)磺酰氯可与白磷发生反应为:P4+ 10SO2Cl2= 4PCl5+ 10SO2↑,若生成1molSO2,则转移电子的物质的量为_____mol。
(3)某学习小组的同学依据反应:SO2(g)+ Cl2(g) SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图。
SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图。
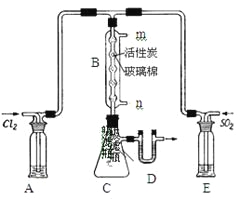


①若用浓盐酸与二氧化锰为原料制取Cl2,其反应的化学方程式为_____。
②上图所示的装置说法正确的是_____(不定项选择)。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和Na2SO3溶液
b.B处反应管内五球中玻璃棉上的活性炭作催化剂
c.B处反应管冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U形管中盛放的可能是碱石灰
③从化学平衡移动角度分析,反应管通水冷却的目的为______。
(4)GET公司开发的Li-SO2Cl2军用电池,其示意图如图所示,
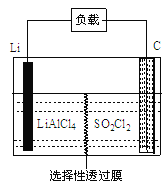
已知电池反应为:2Li + SO2Cl2=" 2LiCl" + SO2↑;则电池工作时,正极的电极反应式为_______。
-
二氯化砜(SO2Cl2)是一种无色液体,主要用于有机物和无机物的氯化等。其熔点为-54.1℃.沸点为69.2℃;常温下比较稳定,受热易分解,遇水剧烈反应生成硫酸和盐酸。
(1)制备。实验室可利用SO2和Cl2按下列装置制取少量SO2Cl2(丙中放有樟脑液,起催化作用)。已知SO2(g)+Cl2(g) SO2Cl2(g) △H<0
SO2Cl2(g) △H<0
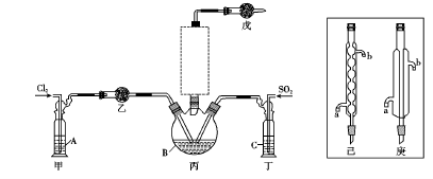
①可以用浓盐酸和酸性高锰酸钾制取氯气,该反应的化学方程式为 ;溶液A为 。
②上图实框中仪器己的名称为 ;反应装置图的虚框中未画出的仪器是 (填“己”或“庚”)。
③如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是 。
④下列有关说法错误的是 (填编号)。
a.乙、戊装置相同,在实验中的作用也完全相同
b.甲、丁装置为洗气装置,可用于气体的除杂和干燥
c.组装仪器后首先要进行的操作是检查装置的气密性
d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等
(2)提纯。将收集到的产物进行减压蒸馏,减压蒸馏的目的是 。
(3)测定。取1.00g蒸馏后液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.60g,则所得蒸馏成分中二氯化砜的质量百分含量为 %。
(4)贮存。二氯化砜应储存于阴凉、干燥、通风良好的库房。但久置后微显黄色,其原因是 。
-
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分【解析】
SO2Cl2 SO2↑+Cl2↑ SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
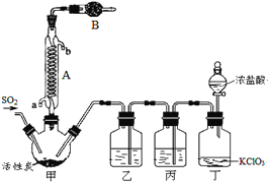
(1)仪器A冷却水的进口为___(填“a”或“b”)。
(2)仪器B中盛放的药品是___。此仪器作用为:___。
(3)实验时,装置丁中发生反应的离子方程式为___。
(4)装置丙的作用为___,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为___。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H═H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是___。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):___。
-
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾
②易分【解析】
SO2Cl2  SO2↑+Cl2↑ SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
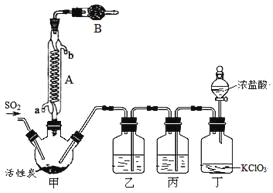
(1)仪器A冷却水的进口为 (填“a”或“b”)。
(2)仪器B中盛放的药品是 。
(3)实验时,装置丁中发生反应的离子方程式为 。
(4)装置丙的作用为 ,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为 。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+ SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是 。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液): 。
-
硫酰氯(SO2C12)常用于制造医药品、染料等。通常情况下其熔点为-54.1℃,沸点69.2℃,遇水发生剧烈反应生成氯化氢气体。某实验小组拟用干燥的氯气和二氧化硫在活性炭催化下制取硫酰氯,其实验装置如下:
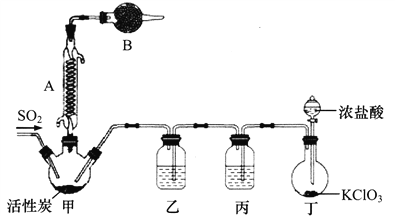
(1)有关冷凝管的使用原理,下列说法正确的是(填字母)______________。
a.蒸气冷凝在内管的外壁上
b.当蒸馏液体的沸点超过140℃,水冷易炸裂仪器,此时多采用空气冷凝管
c.蛇形冷凝管多用于有机制备的回流,适用于沸点较低的液体
d.内外管所围出的空间为行水区,有吸收蒸气热量并将热量移走的功用
(2)B中的试剂为___________,作用为______________________________。
(3)在不改变装置的前提下,丁中的KClO3可用_____________代替(填化学式)。
(4)该小组向Cu(NO3)2·3H2O晶体中滴加SO2C12制备少量无水Cu(NO3)2。
①请写出SO2C12与水反应的化学方程式__________________________________。
②滴加SO2C12的作用除了吸水之外,还有_____________________________。
(5)测定无水Cu(NO3)2的纯度,可用分光光度法。现测得[Cu(NH3)4]2+的吸光度A与Cu2+标准浓度关系如图所示(已知4NH3·H2O+Cu2+==[Cu(NH3)4]2++4H2O)。
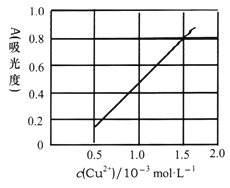
称取0.3150g制得的无水Cu(NO3)2样品,用蒸馏水溶解并配制成100mL溶液,用__________(填仪器名称)准确量取10.00mL,加过量氨水,再用蒸馏水稀释至100mL,测得其吸光度A=0.8。则此无水Cu(NO3)2样品的纯度是___________(保留三位有效数字)。
-
磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2在活性炭作用下反应制取少量的SO2Cl2,装置如图所示(部分夹持装置省略)。已知SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,遇水能发生剧烈的水解反应,并产生白雾。
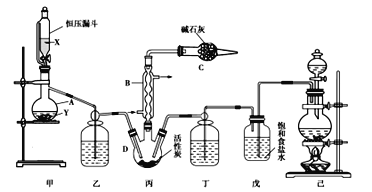
(1)仪器B的名称为_____,由仪器B的使用可知SO2与Cl2反应的ΔH____(填“>”或“<”)0。
(2)仪器C的作用是________________________________。
(3)试剂X、Y的组合最适宜的是______。
a.18.4mol/LH2SO4溶液+Cu b.4mol/LHNO3溶液+Na2SO3 c.75%H2SO4溶液+K2SO3
(4)反应结束后,将丙中产物分离的实验操作的名称是______。
(5)分离产物后,向获得的SO2Cl2中加入足量NaOH溶液,振荡、静置得到无色溶液w。
①写出该反应的离子方程式:___________。
②检验溶液w中存在SO42-的方法是________。
(6)若反应中消耗的氯气的体积为896 mL(已转化为标准状况,SO2足量),最后得到纯净的磺酰氯3.3 g,则磺酰氯的产率为_________(保留三位有效数字)。
-
碳酸二乙酯( )常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
)常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
| 化学式 | 熔点/℃ | 沸点/℃ | 物理性质 |
| COCl2 | -118 | 8.2 | 微溶于水,溶于芳烃、苯、四氯化碳、氯仿、乙酸等多数有机溶剂,遇水迅速水解,生成氯化氢 |
| SO3 | 16.8 | 44.8 | 溶于水,并与水反应生成硫酸和放出大量的热 |
| SO2Cl2 | -54.1 | 69.1 | 溶于乙酸、苯,与水反应生成H2SO4和HCl |
| CCl4 | -22.9 | 76.8 | 微溶于水,易溶于多数有机溶剂 |
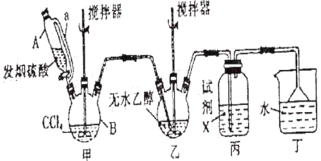
回答下列问题:
(1)甲装置主要用于制备光气(COCl2),先将仪器B中的四氯化碳加热至55~60℃,再缓缓滴加发烟硫酸。
①仪器B的名称是__________。
②仪器A的侧导管a的作用是__________。
(2)试剂X是__________,其作用是__________。
(3)丁装置除了吸收COCl2外,还能吸收的气体是__________(填化学式)。仪器B中四氯化碳与发烟硫酸(用SO3表示)反应只生成两种物质的量为1:1的产物,且均易与水反应,写出该反应化学方程式:__________。
(4)无水乙醇与光气反应生成氯甲酸乙酯,再继续与乙醇反应生成碳酸二乙酯。
①写出无水乙醇与光气反应生成氯甲酸乙酯的化学方程式:__________。
②若起始投入92.0g无水乙醇,最终得到碳酸二乙酯94.4g,则碳酸二乙酯的产率是__________(三位有效数字)
-
二氯化二硫(S2Cl2)可用作橡胶工业的硫化剂,常温下它是橙黄色有恶臭的液体,它的分子结构与H2O2相似,熔点为193K,沸点为411K,遇水很容易反应,产生的气体能使品红褪色,S2Cl2可由干燥的氯气通入熔融的硫中制得。下列有关说法正确的是( )
A. S2Cl2晶体中存在离子键和极性共价键
B. S2Cl2分子中各原子均达到8电子稳定结构
C. S2Cl2的水溶液能导电,所以S2Cl2是电解质
D. S2Cl2与水反应后生成的气体通入石蕊试液中,现象是溶液先变红后褪色
SO2Cl2(l) ΔH=-97.3 kJ/mol
Cl2 c.37Cl2和SO
Cl2 d.无法判断








