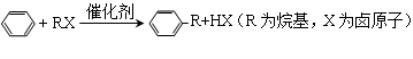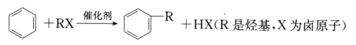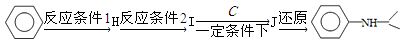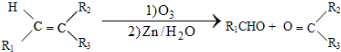-
芳香化合物在催化剂催化下与卤代烃发生取代反应称为Friedel-Crafts烷基化反应。某科研小组以苯和氯代叔丁烷[ClC(CH3)3]为反应物,无水AlCl3为催化剂条件下制备叔丁基苯(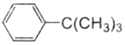 )。
)。
反应如下: +ClC(CH3)3
+ClC(CH3)3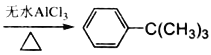 +HCl
+HCl
已知下列信息:
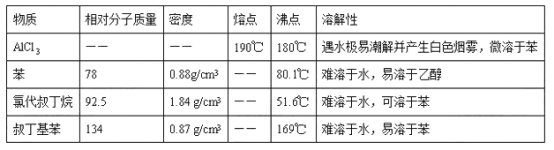
| 物质 | 相对分子质量 | 密度 | 熔点 | 沸点 | 溶解性 |
| AlCl3 | —— | —— | 190℃ | 180℃ | 遇水极易潮解并产生白色烟雾,微溶于苯 |
| 苯 | 78 | 0.88g/cm3 | —— | 80.1℃ | 难溶于水,易溶于乙醇 |
| 氯代叔丁烷 | 92.5 | 1.84 g/cm3 | —— | 51.6℃ | 难溶于水,可溶于苯 |
| 叔丁基苯 | 134 | 0.87 g/cm3 | —— | 169℃ | 难溶于水,易溶于苯 |
I、如下图是实验室制备无水AlCl3的实验装置:
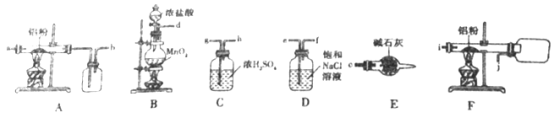
(1)E装置中的仪器名称是_______________。
(2)写出B装置中发生反应的离子方程式:________________________。
(3)选择合适的装置制备无水AlCl3正确的连接顺序为:_____________ (写导管口标号)。
(4)下列操作正确的是________。
甲:先加热硬质玻璃管再加热圆底烧瓶
乙:先加热圆底烧瓶再加热硬质玻璃管
(5)E装置的作用是:_______________________。
II、实验室制取叔丁基苯装置如图:
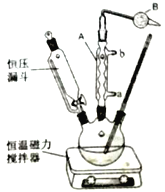
在三颈烧瓶中加入50mL的苯和适量的无水AlCl3,由恒压漏斗滴加氯代叔丁烷[ClC(CH3)3]10mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20g。
(6)使用恒压漏斗的优点是____________________;加无水MgSO4固体的作用是___________。
(7)上述反应后混合物的洗涤所用的试剂有如下三种,正确的顺序是_____________。
①5%Na2CO3溶液 ②稀盐酸 ③H2O
(8)叔丁基苯的产率为______。(保留3位有效数字)
【答案】 干燥管 MnO2+4H++2C1-=Mn2++Cl 2↑+2H2O d、e、f、g、h、i、j、c 乙 防止空气中的水蒸气进入,还吸收多余的氯气 使液体顺利滴下 干燥 ②①③ 75.0%
【解析】I.(1). E装置中的仪器名称是干燥管,故答案为:干燥管;
(2). 在B装置中,浓盐酸和MnO2反应生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl−=Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl−=Mn2++Cl2↑+2H2O;
(3). B装置产生的氯气中混有氯化氢和水蒸气杂质,用D装置除去HCl 杂质,C装置除去水蒸气杂质,由于氯化铝易升华,产生的氯化铝颗粒易堵塞导气管,所以得到纯净的氯气后在F装置中和铝反应制取氯化铝而不用A装置,根据信息可知氯化铝遇水极易潮解并产生白色烟雾,所以最后必须用E装置吸收多余的氯气并可以防止空气中的水蒸气进入F装置中,因此制备无水氯化铝正确的连接顺序为d、e、f、g、h、i、j、c,故答案为:d、e、f、g、h、i、j、c;
(4). 制备无水氯化铝时,应先加热圆底烧瓶产生氯气,将装置中的空气排尽,以防止铝粉被空气中的氧气氧化,故答案为:乙;
(5). 由上述分析可知,用E装置可以吸收多余的氯气并能防止空气中的水蒸气进入F装置中使氯化铝潮解,故答案为:防止空气中的水蒸气进入,还吸收多余的氯气;
II. (6). 使用恒压漏斗可以平衡漏斗内外压强,使液体顺利滴下,在洗涤后所得产物中加入少量无水MgSO4固体,目的是吸收产品中少量的水分,起到干燥的作用,故答案为:使液体顺利滴下;干燥;
(7). 稀盐酸洗涤可以除去氯化铝杂质,再用5%Na2CO3溶液除去过量的盐酸,最后用水洗涤除去剩余的5%Na2CO3,故答案为:②①③;
(8).加入苯的物质的量为50mL×0.88g/mL÷78g/mol=0.56mol,氯代叔丁烷的物质的量为10mL×1.84g/mL÷92.5g/mol=0.199mol,由反应方程式 +ClC(CH3)3
+ClC(CH3)3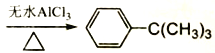 +HCl可知,加入的苯过量,则理论上生成叔丁基苯的质量为:0.199mol×134g/mol=26.66g,叔丁基苯的产率为:
+HCl可知,加入的苯过量,则理论上生成叔丁基苯的质量为:0.199mol×134g/mol=26.66g,叔丁基苯的产率为: ×100%=75.0%,故答案为:75.0%。
×100%=75.0%,故答案为:75.0%。
【题型】实验题
【结束】
9
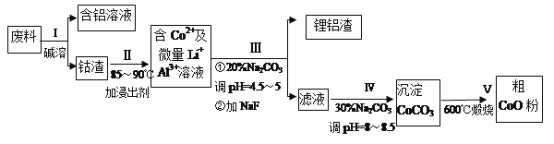
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面:锂混杂于其中。(已知Co2O3的氧化性>Cl2的氧化性)从废料中回收氧化钴(CoO)的工艺流程如下:
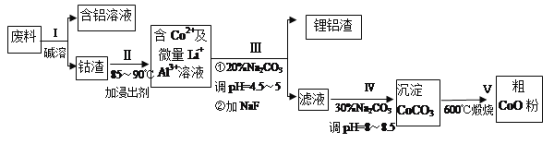
已知:①CoCO3的溶度积为:Ksp=1.0×10-13;
②溶液中离子浓度小于1.0×10-5mol/L时认为该离子沉淀完全。
(1)“碱溶”前通常将废料粉碎,其目的是____________。
(2)过程I中采用NaOH溶液溶出废料中的A1,反应的离子方程式为_________________。
(3)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出含钻物质的反应化学方程式为 (产物中只有一种酸根) _______________________________________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因______________________________________。
(4)过程III得到锂铝渣的主要成分是LiF和AI(OH)3,碳酸钠溶液在产生 Al(OH)3时起重要作用,请写出该反应的离子方程式__________________________________。
(5)将2.0×10-4 mol/LCoSO4与2.2×10-4mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为__________,Co2+是否沉淀完全? __________(填“是”或“否”)。
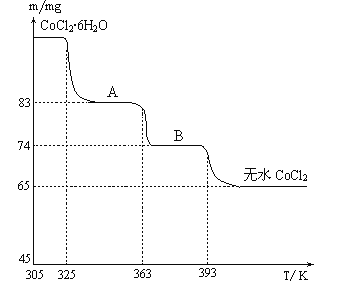
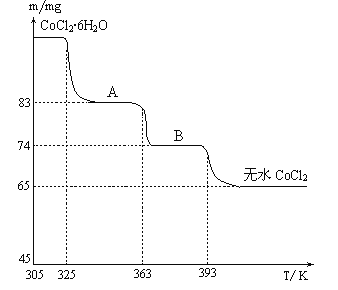
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,物质B的化学式是____________________。
-
芳香化合物在催化剂催化下与卤代烃发生取代反应称为Friedel-Crafts烷基化反应。某科研小组以苯和氯代叔丁烷[ClC(CH3)3]为反应物,无水AlCl3为催化剂条件下制备叔丁基苯( )。反应如下:
)。反应如下:
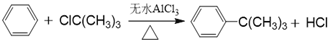 。
。
已知:
(1)AlCl3:熔点:190 ºC,沸点:180 ºC,遇水极易潮解并产生白色烟雾,微溶于苯。
(2)苯:M=78g/mol,ρ:0.88g/cm3,沸点:80.1 ºC,难溶于水,易溶于乙醇。
(3)氯代叔丁烷M=92.5g/mol,ρ:1.84g/cm3,沸点:51.6 ºC,难溶于水,可溶于苯。
(4)叔丁基苯:M=134g/mol,ρ:0.87g/cm3,沸点:169 ºC,难溶于水,易溶于苯。
I、如图是实验室制备无水AlCl3的实验装置:
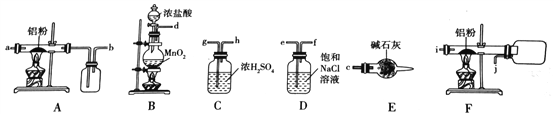
(1)选择合适的装置制备无水AlCl3正确的连接顺序为:_____________________(写导管口标号)。
(2)写出B装置中发生反应的离子方程式:______________。
(3)能否将E装置替换成C装置:______(填“能”或“不能”)理由:__________。
II、实验室制取叔丁基苯装置如图:
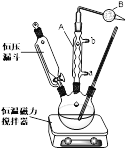
在三颈烧瓶中加入50mL的苯和适量的无水AlCl3,由恒压漏斗滴加氯代叔丁烷[ClC(CH3)3]10mL,一定温度下反应一段时间,将反应后的混合物依次用稀盐酸、5%Na2CO3溶液、H2O洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20g。
(4)仪器A的名称为_______,B中试剂是碱石灰,其作用是_____________________,使用恒压漏斗的优点是__________________________。
(5)用H2O洗涤的目的是______________,加无水MgSO4固体的作用是______________。
(6)叔丁基苯的产率为____________。(保留3位有效数字)
-
芳香化合物在催化剂催化下与卤代烃发生取代反应称为 Friedel- Crafts烷基化反应。某科研小组以苯和氯代叔丁烷[ClC(CH3)3]为反应物,无水AlCl3为催化剂条件下制备叔丁基苯(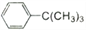 )。反应如下:
)。反应如下: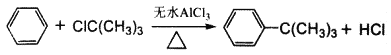
已知下列信息:
I、如图是实验室制备无水AlCl3的实验装置:
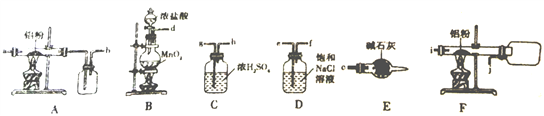
(1)E装置中的仪器名称是____________________。
(2)写出B装置中发生反应的离子方程式:____________________________________。
(3)选择合适的装置制备无水AlCl3正确的连接顺序为:__________________ (写导管口标号)。
(4)下列操作正确的是__________________。
甲:先加热硬质玻璃管再加热圆底烧瓶
乙:先加热圆底烧瓶再加热硬质玻璃管
(5)E装置的作用是:____________________________________。
Ⅱ、实验室制取叔丁基苯装置如图:
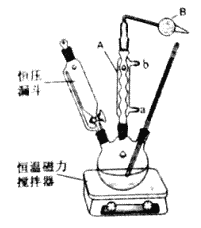
在三颈烧瓶中加入50mL的苯和适量的无水AlCl3,由恒压漏斗滴加氯代叔丁烷[ClC(CH3)3]10mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20g。
(6)使用恒压漏斗的优点是____________________;加无水MgSO4固体的作用是__________________。
(7)上述反应后混合物的洗涤所用的试剂有如下三种,正确的顺序是__________。
①5%Na2CO3溶液 ②稀盐酸 ③H2O
(8)叔丁基苯的产率为__________。(保留3位有效数字)
【答案】 干燥管 MnO2+4H++2Cl- Mn2++Cl2↑+2H2O defghijc 乙 防止空气中的水蒸气进入,吸收多余的氯气 改为使液体顺利滴 干燥 ②①③ 75.0%
Mn2++Cl2↑+2H2O defghijc 乙 防止空气中的水蒸气进入,吸收多余的氯气 改为使液体顺利滴 干燥 ②①③ 75.0%
【解析】(1)根据图示,E装置中的仪器是干燥管,故答案为:干燥管;
(2) B装置中二氧化锰与浓盐酸反应生成氯气,反应的离子方程式为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)制备的氯气中混有氯化氢和水蒸气,需要除去,可以分别选用D(饱和的食盐水)除氯化氢,再用浓硫酸干燥除去水蒸气,由于氯化铝熔沸点相差很小,容易升华和凝华,造成导管的堵塞,不能选取A装置制备,同时需要防止空气中的水蒸气进入,制备无水AlCl3正确的连接顺序为defghijc,故答案为:defghijc;
(4)装置中有空气,需要用生成的氯气排尽,因此乙正确,故答案为:乙;
(5)根据上述(3)的分析,E装置可以防止空气中的水蒸气进入,同时可以吸收多余的氯气,防止污染空气,故答案为:防止空气中的水蒸气进入,吸收多余的氯气;
(6)恒压漏斗可以保持液面上方的气体压强不变,使液体顺利滴下;无水MgSO4固体可以吸收体系中的少量水,故答案为:使液体顺利滴下;干燥;
(7) 根据方程式,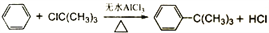 ,生成的叔丁基苯中含有苯、氯代叔丁烷[ClC(CH3)3]以及催化剂无水氯化铝杂质,应用氯化铝和叔丁基苯的沸点相差不大,需要除去,氯化铝易溶于水,但容易水解变浑浊,因此需要稀盐酸洗涤除去氯化铝,再用碳酸钠溶液洗涤除去盐酸,最后水洗除去少量的碳酸钠,故答案为:②①③;
,生成的叔丁基苯中含有苯、氯代叔丁烷[ClC(CH3)3]以及催化剂无水氯化铝杂质,应用氯化铝和叔丁基苯的沸点相差不大,需要除去,氯化铝易溶于水,但容易水解变浑浊,因此需要稀盐酸洗涤除去氯化铝,再用碳酸钠溶液洗涤除去盐酸,最后水洗除去少量的碳酸钠,故答案为:②①③;
(8)反应中的苯为50mL×0.88g/cm3=44g,物质的量= =0.564mol,氯代叔丁烷[ClC(CH3)3]的质量为10mL×1.84 g/cm3=18.4g,物质的量=
=0.564mol,氯代叔丁烷[ClC(CH3)3]的质量为10mL×1.84 g/cm3=18.4g,物质的量= =0.199mol,理论上可以生成叔丁基苯的质量=
=0.199mol,理论上可以生成叔丁基苯的质量= ×134 g/cm3=26.65g,叔丁基苯的产率为
×134 g/cm3=26.65g,叔丁基苯的产率为 ×100%=75.0%,故答案为:75.0%。
×100%=75.0%,故答案为:75.0%。
【题型】实验题
【结束】
9
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面:锂混杂于其中。(已知Co2O3的氧化性>Cl2的氧化性)从废料中回收氧化钴(CoO)的工艺流程如下:
已知:①CoCO3的溶度积为:Ksp=1.0×10-13;
②溶液中离子浓度小于1.0×10-5mol/L时认为该离子沉淀完全。
(1)“碱溶”前通常将废料粉碎,其目的是____________。
(2)过程I中采用NaOH溶液溶出废料中的A1,反应的离子方程式为_________________。
(3)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出含钻物质的反应化学方程式为 (产物中只有一种酸根) _______________________________________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因______________________________________。
(4)过程III得到锂铝渣的主要成分是LiF和AI(OH)3,碳酸钠溶液在产生 Al(OH)3时起重要作用,请写出该反应的离子方程式__________________________________。
(5)将2.0×10-4 mol/LCoSO4与2.2×10-4mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为__________,Co2+是否沉淀完全? __________(填“是”或“否”)。
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,物质B的化学式是____________________。
-
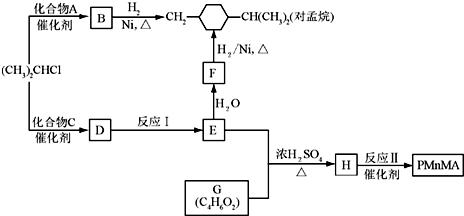
优良的有机溶剂对孟烷、耐热型特种高分子功能材料PMnMA的合成路线如下:
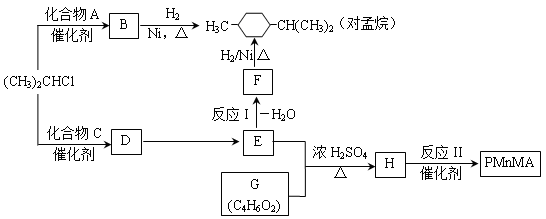
己知芳香化合物苯环上的氢原子可被卤代烷中的烷基取代。如:
Ⅰ B为芳香烃。
(1)由B生成对孟烷的反应类型是 。
(2)(CH3)2CHCl与A生成B的化学方程式是 。
(3)A的同系物中相对分子质量最小的物质是 (填写名称)。
Ⅱ 1.08g的C与足量饱和溴水完全反应生成3.45 g白色沉淀。E不能使Br2的CC14溶液褪色。
(1)F的官能团是 。
(2)C的结构简式是 。
(3)反应I的条件是 。
(4)下列说法正确的是(选填字母) 。
a.B可使酸性高锰酸钾溶液褪色
b.C不存在醛类同分异构体
c.D的酸性比E弱
d.E的沸点高于对孟烷
(5)G有三种不同环境的H原子,且个数比为3:2:1。G能与NaHCO3溶液反应放出CO2。反应II的化学方程式是 。
-
(17分)
优良的有机溶剂对孟烷、耐热型特种高分子功能材料PMnMA的合成路线如下:
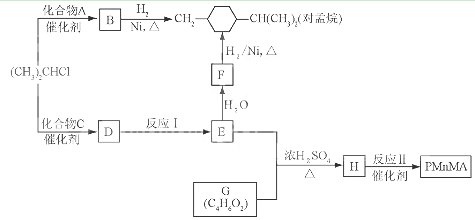
己知芳香化合物苯环上的氢原子可被卤代烷中的烷基取代。如:
(1)B为芳香烃。
①由B生成对孟烷的反应类型是________
②(CH3 )2 CHCl与A生成B的化学方程武是 ________
③A的同系物中相对分子质量最小的物质是________
(2) 1.08g的C与饱和溴水完全反应生成3.45 g白色沉淀。E不能使Br2的CC14溶液褪色.
①F的官能团是 ________
②C的结构简式是________
③反应I的化学方程式是________
(3)下列说法正确的是(选填字母)________
a. B可使酸性高锰放钾溶液褪色 b. C不存在醛类同分异构体
c. D的酸性比E弱 d. E的沸点高于对孟烷
(4) G的核磁共振氢谱有3种峰,其峰面积之比为3:2:1。G与NaHCO3反应放出CO2。反应II的化学方程式是________
-
优良的有机溶剂对孟烷、耐热型特种高分子功能材料PMnMA的合成路线如下:
己知芳香化合物苯环上的氢原子可被卤代烷中的烷基取代.如:

(1)B为芳香烃.
①由B生成对孟烷的反应类型是______.
②(CH3 )2CHCl与A生成B的化学方程式是______.
③A的同系物中相对分子质量最小的物质是______.
(2)1.08g的C与饱和溴水完全反应生成3.45g白色沉淀.E不能使Br2的CCl4溶液褪色.
①F的官能团是______.
②C的结构简式是______.
③反应I的化学方程式是______.
(3)下列说法正确的是(选填字母)______.
a.B可使酸性高锰酸钾溶液褪色 b.C不存在醛类同分异构体
c.D的酸性比E弱 d.E的沸点高于对孟烷
(4)G的核磁共振氢谱有3种峰,其峰面积之比为3:2:1.G与NaHCO3反应放出CO2.反应II的化学方程式是______.
-
合成有机溶剂M和高分子材料N的路线如图:

己知:芳香族化合物苯环上的氢原子可被卤代烷中的烷基取代.如:

(1)写出反应类型.反应Ⅰ__________ 反应Ⅱ____________。
(2)写出D的分子式___________。写出G的结构简式_____________。
(3)写出E生成F的化学反应方程式______________________________。
(4)E在浓硫酸作用下转化为F时,除生成副产物G,还会生成高分子副产物,写出该副产物的结构简式____________________________。
(5)属于酯类且含甲基F的同分异构体有多种,写出其中一种的结构简式______________。
(6)写出高分子化合物N的结构简式_________________(任写一种)。A有2种结构,可通过定量实验来确定其准确结构,该定量实验可通过A与__________(填写物质名称)反应来实现。
-
优良的有机溶剂对孟烷和耐热型特种高分子功能材料PMnMA的合成路线如下:
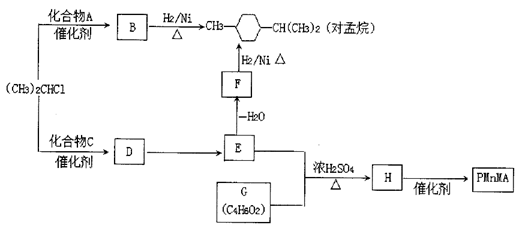
已知:①芳香族化合物苯环上的氢原子可被卤代烷中的烷基取代。如:
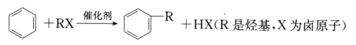
②0.01molC质量为1.08g,能与饱和溴水完全反应生成3.45 g白色沉淀,E不能使Br2的CCl4溶液褪色。
③G的核磁共振氢谱有3种峰,其峰面积之比为3:2:1,G与NaHCO3溶液反应放出气体。
根据以上信息回答以下问题。
(1)化合物A的名称为________;F的官能团结构简式为________;C的结构 简式为________
(2)下列说法正确的是(填选项字母)________。
a.B可使酸性高锰酸钾溶液褪色
b.C不存在芳香族醛类同分异构体
c.D的酸性比E弱
d.F不能使溴水褪色
(3)①E和G反应生成H的化学方程式为________,其反应类型为________;②PMnMA的结构简式为________,由H生成该有机物的反应类型为________。
(4)G的能水解的链状同分异构体有________种,其中不能发生银镜反应的有机物结构简式为(写出一种即可)________。
-
席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:
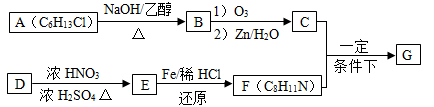
已知以下信息:
①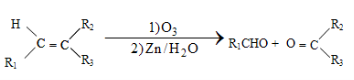
②1molB经上述反应可生成2molC,且C不能发生银镜反应。
③D属于单取代芳香烃,其相对分子质量为106。
④核磁共振氢谱显示F苯环上有两种化学环境的氢。
⑤
回答下列问题:
(1)由A生成B的化学方程式为______________,反应类型为________。
(2)D的化学名称是________,由D生成E的化学方程式为:_______________。
(3)G的结构简式为__________________。
(4)F的同分异构体中含有苯环的有多种(不考虑立体异构)。其中核磁共振氢谱中有4组峰,且面积比为6:2:2:1的是____________。(写出其中的一种的结构简式)。
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。
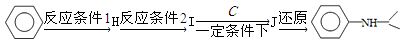
反应条件1所选择的试剂为_______;反应条件2所选择的试剂为________;I的结构简式为____________。
-
席夫碱类化合物G在催化、药物、新材料等方面有广泛应用.合成G的一种路线如下:
已知以下信息:
①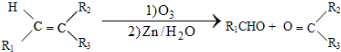
②1molB经上述反应可生成2molC,且C不能发生银镜反应.
③D属于单取代芳香烃,其相对分子质量为106.
④核磁共振氢谱显示F苯环上有两种化学环境的氢.
⑤RNH2+


回答下列问题:
(1)由A生成B的化学方程式为_____________,反应类型为_____________;
(2)E的化学名称是_____________,由D生成E的化学方程式为_____________;
(3)G的结构简式为_____________;
(4)F的同分异构体中含有苯环的还有_____________种(不考虑立体异构),其中核磁共振氢谱中有4组峰,且面积比为6:2:2:1的是_____________,(写出其中的一种的结构简式)。
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。
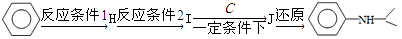
反应条件1所选择的试剂为_____________;反应条件2所选择的试剂为_____________;I的结构简式为_____________。
 )。反应如下:
)。反应如下: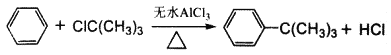



Mn2++Cl2↑+2H2O defghijc 乙 防止空气中的水蒸气进入,吸收多余的氯气 改为使液体顺利滴 干燥 ②①③ 75.0%
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
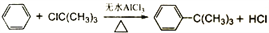 ,生成的叔丁基苯中含有苯、氯代叔丁烷[ClC(CH3)3]以及催化剂无水氯化铝杂质,应用氯化铝和叔丁基苯的沸点相差不大,需要除去,氯化铝易溶于水,但容易水解变浑浊,因此需要稀盐酸洗涤除去氯化铝,再用碳酸钠溶液洗涤除去盐酸,最后水洗除去少量的碳酸钠,故答案为:②①③;
,生成的叔丁基苯中含有苯、氯代叔丁烷[ClC(CH3)3]以及催化剂无水氯化铝杂质,应用氯化铝和叔丁基苯的沸点相差不大,需要除去,氯化铝易溶于水,但容易水解变浑浊,因此需要稀盐酸洗涤除去氯化铝,再用碳酸钠溶液洗涤除去盐酸,最后水洗除去少量的碳酸钠,故答案为:②①③;=0.564mol,氯代叔丁烷[ClC(CH3)3]的质量为10mL×1.84 g/cm3=18.4g,物质的量=
=0.199mol,理论上可以生成叔丁基苯的质量=
×134 g/cm3=26.65g,叔丁基苯的产率为
×100%=75.0%,故答案为:75.0%。


 )。
)。 +HCl
+HCl

 +HCl可知,加入的苯过量,则理论上生成叔丁基苯的质量为:0.199mol×134g/mol=26.66g,叔丁基苯的产率为:
+HCl可知,加入的苯过量,则理论上生成叔丁基苯的质量为:0.199mol×134g/mol=26.66g,叔丁基苯的产率为:

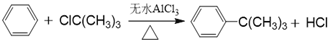 。
。