-
(2007•四川)某化学兴趣小组的同学用纯锌粒与稀盐酸反应制氢气时,发现产生气泡的速度较慢.就采用补加浓度更大的盐酸来提高反应速度,但不小心误加了CuSO4溶液,结果产生气泡的速度也大大加快,于是他们对此问题进行实验探究.
[提出问题]:此反应速度明显加快的原因是什么?
[猜想]:①加入的CuS04溶液中的SO42-使反应速度加快
②加入的CuSO4溶液中的H2O使反应速度加快
③加入的CuSO4溶液中的Cu2+使反应速度加快
④加入CuSO4溶液后,锌置换出的少量铜使反应速度加快
你认为最不可能的猜想是______ (填序号,下同).
[实验验证]:用a、b、c、d四支干净试管取等质量且过量的纯锌粒后,再分别向试管中加入同体积同溶质质量分数的稀盐酸.向试管中加锌粒的操作为:______.
请继续完成下表:
[结论]:在锌和稀盐酸反应时,当加入可溶性铜盐或铜粉,可加快化学反应速度.实验步骤 实验主要现象 实验结论 1.向a试管中加入少量NaCl晶体 产生气泡速度不变 ______离子对反应速度无影响 2.向b试管中加入少量______晶体 产生气泡速度不变 猜想①不成立 3.向c试管中加入少量Cu粉 产生气泡速度明显加快 猜想______成立 4.向d试管中加入少量Cu粉,立即再加入CuSO4粉末. 产生气泡速度,与第3步c试管的速度几乎一样快 猜想______成立 九年级化学解答题中等难度题查看答案及解析
-
某化学兴趣小组的同学用纯锌粒与稀盐酸反应制氢气时,发现产生气泡的速度较慢.就采用补加浓度更大的盐酸来提高反应速度,但不小心误加了CuSO4溶液,结果产生气泡的速度也大大加快,于是他们对此问题进行实验探究.
[提出问题]:此反应速度明显加快的原因是什么?
[猜想]:①加入的CuS04溶液中的SO42-使反应速度加快
②加入的CuSO4溶液中的H2O使反应速度加快
③加入的CuSO4溶液中的Cu2+使反应速度加快
④加入CuSO4溶液后,锌置换出的少量铜使反应速度加快
你认为最不可能的猜想是______ (填序号,下同).
[实验验证]:用a、b、c、d四支干净试管取等质量且过量的纯锌粒后,再分别向试管中加入同体积同溶质质量分数的稀盐酸.向试管中加锌粒的操作为:______.
请继续完成下表:
[结论]:在锌和稀盐酸反应时,当加入可溶性铜盐或铜粉,可加快化学反应速度.实验步骤 实验主要现象 实验结论 1.向a试管中加入少量NaCl晶体 产生气泡速度不变 ______离子对反应速度无影响 2.向b试管中加入少量______晶体 产生气泡速度不变 猜想①不成立 3.向c试管中加入少量Cu粉 产生气泡速度明显加快 猜想______成立 4.向d试管中加入少量Cu粉,立即再加入CuSO4粉末. 产生气泡速度,与第3步c试管的速度几乎一样快 猜想______成立 九年级化学解答题中等难度题查看答案及解析
-
某化学兴趣小组的同学用纯锌粒与稀盐酸反应制氢气时,发现产生气泡的速度较慢.就采用补加浓度更大的盐酸来提高反应速度,但不小心误加了CuSO4溶液,结果产生气泡的速度也大大加快,于是他们对此问题进行实验探究.
【提出问题】:此反应速度明显加快的原因是什么?
【猜想】:①加入的CuS04溶液中的SO42-使反应速度加快
②加入的CuSO4溶液中的H2O使反应速度加快
③加入的CuSO4溶液中的Cu2+使反应速度加快
④加入CuSO4溶液后,锌置换出的少量铜使反应速度加快
你认为最不可能的猜想是______ (填序号,下同).
【实验验证】:用a、b、c、d四支干净试管取等质量且过量的纯锌粒后,再分别向试管中加入同体积同溶质质量分数的稀盐酸.
请你帮助他们继续完成下表:
【结论】:在锌和稀盐酸反应时,当加入可溶性铜盐或铜粉,可加快化学反应速度.实验操作 实验现象 实验结论 1.向试管a中加入少量NaCl晶体 产生气泡速度不变 ______离子对反应速度无影响 2.向试管b中加入少量______晶体 产生气泡速度不变 猜想①不成立 1.向试管c中加入少量Cu粉 产生气泡速度明显加快 猜想______成立 1.向试管d中加入少量Cu粉,立即再加入CuSO4粉末. 产生气泡速度,与第3步试管c的速度几乎相同 猜想______成立 九年级化学解答题中等难度题查看答案及解析
-
(5分)某化学兴趣小组的同学用纯锌粒与稀盐酸反应制氢气时,发现产生气泡的速度较慢。就采用补加浓度更大的盐酸来提高反应速度,但不小心误加了CuSO4溶液,结果产生气泡的速度也大大加快,于是他们对此问题进行实验探究。
[提出问题]:此反应速度明显加快的原因是什么?
[猜想]:①加入的CuS04溶液中的SO42-使反应速度加快
②加入的CuSO4溶液中的H2O使反应速度加快
③加入的CuSO4溶液中的Cu2+ 使反应速度加快
④加入CuSO4溶液后,锌置换出的少量铜使反应速度加快
你认为最不可能的猜想是__________ (填序号,下同)。
[实验验证]:用a、b、c、d四支干净试管取等质量且过量的纯锌粒后,再分别向试管中加入同体积同溶质质量分数的稀盐酸。
请你帮助他们继续完成下表:
实验操作
实验现象
实验结论
1.向试管a中加入少量NaCl晶体
产生气泡速度不变
_____离子对反应速度无影响
2.向试管b中加入少量__________晶体
产生气泡速度不变
猜想①不成立
1.向试管c中加入少量Cu粉
产生气泡速度明显加快
猜想_____成立
1.向试管d中加入少量Cu粉,立即再加入CuSO4粉末。
产生气泡速度,与第3步试管c的速度几乎相同
猜想_____成立
[结论]:在锌和稀盐酸反应时,当加入可溶性铜盐或铜粉,可加快化学反应速度。
九年级化学探究题简单题查看答案及解析
-
化学兴趣小组的同学准备自制氢气做氢气球.他们取用铁丝和铝条打磨后,分别放入盛有稀盐酸的试管中,发现铁丝只有细小的气泡缓慢产生,而铝条迅速反应,产生的气泡混合酸一起冲出试管,他们一筹莫展,你能帮助他们吗?
(1)根据金属活动性顺序,你认为选择金属______可能更为合适.按照你的选择,写出反应的化学方程式______.
(2)如果要组装一个能即制即停的装置,可以选择下列装置中的______.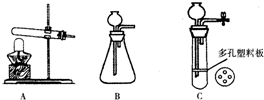
(3)这样制得的氢气中可能含有氯化氢和水蒸气等杂质,将所得气体先通入______溶液,再通入______即可得到纯净的氢气.九年级化学解答题中等难度题查看答案及解析
-
某兴趣小组的同学们在做锌与硫酸反应制取氢气时,无意中滴入几滴硫酸铜溶液,发现锌粒表面产生的气泡速度明显加快,且表面附着有红色物质。该现象引起了同学们的兴趣。
小明同学提出猜测:硫酸铜溶液可能是该反应的催化剂。其他同学不同意他的猜测,原因是______。
(提出问题)硫酸铜溶液的体积对锌与稀硫酸反应的速率有影响吗?
(设计实验)室温下,兴趣小组的同学们将过量且表面积相同的锌粒,分别加入到5份10mL10%的稀硫酸中,并在每份中加入不同体积的3%的硫酸铜溶液和水,记录获得相同体积的氢气所需的时间,从而确定产生气体的速率。
实验编号
1
2
3
4
5
稀硫酸体积(mL)
10
10
10
10
10
硫酸铜溶液(mL)
0
2
V
7
10
水(mL)
10
8
5
3
0
收集10mL氢气所需时间(s)
26
20
14
10
31
(实验结论与反思)
(1)上表中V=______,实验中加入水的目的是______。
(2)由实验可知,硫酸铜溶液对锌与稀硫酸反应速率的影响规律是______。
(3)写出锌粒与稀硫酸反应的化学方程式:______。
(4)除了测量收集等体积氢气所需的时间外,还可以通过测量______的方法比较锌粒与稀硫酸反应的速率。
(继续探究)小明认为是硫酸铜溶液中的某些粒子影响了锌粒与稀硫酸反应的速率。
(提出猜想)猜想一:铜离子影响了锌粒与稀硫酸反应的速率。
猜想二:______影响了锌粒与稀硫酸反应的速率。
猜想三:______影响了锌粒与稀硫酸反应的速率。
(进行实验)针对猜想一,请设计一个实验验证。
实验操作
实验现象及结论
_______
________
九年级化学科学探究题困难题查看答案及解析
-
化学兴趣小组的同学将足量的锌粒加入到浓硫酸中,发现有大量的气泡放出,他们对气体的成分进行了探究。
【提出问题】锌粒加入浓硫酸后生成的气体是什么?
【查阅资料】
①浓硫酸能与锌反应,但不产生氢气,也不会产生氧气;
②SO2有刺激性气味,易溶于水,能使品红(一种红色色素)溶液褪色。
【提出猜想】
甲:气体是H2;
乙:气体是SO2;
丙:气体是SO2和H2。
【实验探究】
为了验证上述猜想,同学们在老师的指导下设计了如下图的装置(部分夹持器材略去,假设每个能发生的反应都完全进行)进行探究:
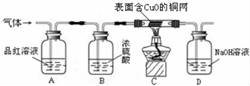
(1)实验开始后,观察到A中品红溶液褪色,证明气体中含有 。
(2)B装置的作用是 。
(3)C装置在点燃酒精灯加热之前应先通一段时间的气体,目的是 ;加热一段时间后,观察到 ,证明气体中含有H2。
(4)写出D瓶中发生的反应的化学方程式 。
【讨论】
(1)锌和浓硫酸反应生成硫酸锌、水和二氧化硫,为什么在反应过程中又产生了氢气呢?用文字简述原因: 。
(2)锌与浓硫酸和稀硫酸反应都可以产生硫酸锌,如果需要制取硫酸锌,用锌与稀硫酸反应的优点是 (任填一种合理的答案)。
九年级化学探究题中等难度题查看答案及解析
-
化学兴趣小组的同学将足量的锌粒加入到浓硫酸中,发现有大量的气泡放出,他们对气体的成分进行了探究。
(提出问题)锌粒加入浓硫酸后生成的气体是什么?
(查阅资料)
①浓硫酸能与锌反应,但不产生氢气,也不会产生氧气;
②SO2有刺激性气味,易溶于水,能使品红(一种红色色素)溶液褪色。
(提出猜想)
甲:气体是CO2;乙:气体是H2;丙:气体是SO2;丁:气体是SO2和H2
(实验探究)
为了验证上述猜想。同学们在老师的指导下设计了如图的装置(部分夹持器材略去假设每个能发生的反应都完全进行)进行探究:
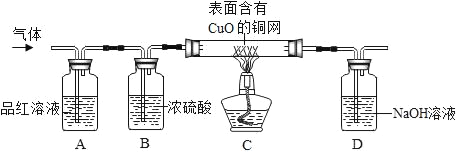
(1)同学们都认为甲的猜想不合理,原因是_____。
(2)实验开始后,观察到A中品红溶液褪色,证明气体中含有_____。
(3)B装置的作用是_____。
(4)C装置在点燃酒精灯加热之前应先通一段时间的气体,目的是_____。加热一段时间后,观察到_____,证明气体中含有H2。
(讨论)
(5)①锌和浓硫酸反应生成硫酸锌、水和二氧化硫,为什么在反应过程中又产生了氢气呢?简述原因:_____。
②锌与浓硫酸和稀硫酸反应都可以产生硫酸锌,如果需要制取硫酸锌,用锌与稀硫酸反应的优点是_____。
九年级化学科学探究题中等难度题查看答案及解析
-
化学兴趣小组的同学将足量的锌粒加入到浓硫酸中,发现有大量的气泡放出,他们对气体的成分进行了探究。
(提出问题)锌粒加入浓硫酸后生成的气体是什么?
(查阅资料)①浓硫酸能与锌反应,但不产生氢气,也不会产生氧气;
②SO2有刺激性气味,易溶于水,能使品红(一种红色色素)溶液褪色;
③SO2、CO2与氢氧化钠溶液反应原理相同,且反应前后硫元素化合价不变。
(提出猜想)甲:气体是H2;
乙:气体是:SO2;
丙:气体是_____。
(实验探究)为了验证上述猜想,同学们在老师的指导下设计了如图的装置(部分夹持器材略去,假设每个能发生的反应都完全进行)进行探究:
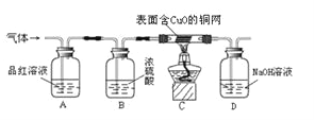
(1)实验开始后,观察到A中品红溶液褪色,证明气体中含有_____。
(2)B装置的作用利用了浓硫酸的_____性。
(3)C装置在点燃酒精灯加热之前应先通一段时间的气体,目的是_____,加热一段时间后,观察到_____的现象,证明气体中含有H2。
(4)D装置的目的是吸收尾气中的SO2,防止造成空气污染。请你写出D瓶中发生反应的化学方程式_____。
九年级化学科学探究题中等难度题查看答案及解析
-
化学兴趣小组的同学将足量的锌粒加入到浓硫酸中,发现有大量的气泡放出,他们对气体的成分进行了探究。
(提出问题)锌粒加入浓硫酸后生成的气体是什么?
(查阅资料)
①浓硫酸能与锌反应,但不产生氢气,也不会产生氧气;
②SO2有刺激性气味,易溶于水,能使品红(一种红色色素)溶液褪色。
(提出猜想)
甲:气体是CO2;乙:气体是H2;丙:气体是SO2;丁:气体是SO2和H2
(实验探究)
为了验证上述猜想。同学们在老师的指导下设计了如图的装置(部分夹持器材略去假设每个能发生的反应都完全进行)进行探究:
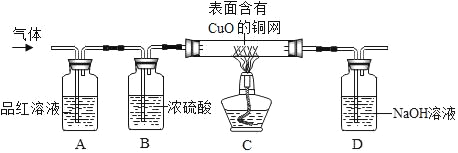
(1)同学们都认为甲的猜想不合理,原因是_____。
(2)实验开始后,观察到A中品红溶液褪色,证明气体中含有_____。
(3)B装置的作用是_____。
(4)C装置在点燃酒精灯加热之前应先通一段时间的气体,目的是_____。加热一段时间后,观察到_____,证明气体中含有H2。
(讨论)
(5)①锌和浓硫酸反应生成硫酸锌、水和二氧化硫,为什么在反应过程中又产生了氢气呢?简述原因:_____。
②锌与浓硫酸和稀硫酸反应都可以产生硫酸锌,如果需要制取硫酸锌,用锌与稀硫酸反应的优点是_____。
九年级化学科学探究题中等难度题查看答案及解析