-
(1)某科研小组研究:在恒温、恒容(容器容积为2L,)下N2(g)+3H2(g) 2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
①此条件下反应的平衡常数K= 。
②若初始条件n (NH3)= 2mol,反应达到平衡时NH3的转化率为 ,
③若初始条件n (H2)= 6mol 、n (N2) =2mol,反应达到平衡时NH3的体积分数 43%,此时移除0.5 mol NH3 ,再次达到平衡时NH3的体积分数 43% (填 “>、<、=”)
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g),ΔH>0
4NO2(g)+O2(g),ΔH>0
①下表为该反应在T1温度下的部分实验数据
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的平均生成速率为 。
②现以NO2、O2、N2O5、熔融盐NaNO3组成的燃料电池,采用电解法制备N2O5,装置如图所示。
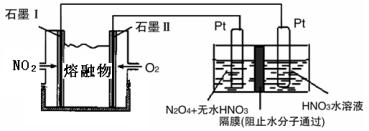
写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。
-
(8分)恒温下,将a molN2与b molH2的混合气体通入10L 固定容积的密封容器中,发生如下反应:
N2 (g) +3H2(g) 2NH3(g)
2NH3(g)
(1)若反应进行到10 min时,n (N2) = 10 mol,n (NH3) = 6 mol,计算a的值以及用氢气表示的反应的平均速率。
(2)反应达平衡时,混合气体的体积为716.8 L(标准状况下),其中所含氨气的体积分数为25%,计算平衡时氨气的物质的量以及氢气的转化率。
-
(实验班做)
恒温下,将a mol N2与b mol H2的混合气体通入一个固体容积的密闭容器中,发生如下反应:
N2(g)+3H2(g)  2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol, a=________ 。
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。nt(NH3) __________。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)= _____ 。
(4)原混合气体中,a:b=_____ 。
(5)将1molN2和3molH2合成NH3反应时,下列叙述能说明该反应已达到化学平衡状态的是(填标号)_________ ;
A 容器内的总压强不随时间而变化
B反应后混合气体的密度不再发生变化
C三种气体的浓度相等且保持不变
D NH3的分解速率与生成速率相等
E.混合气体的平均相对分子质量不再发生变化
-
(10分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)  2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,n(N2)=13 mol,n (NH3)=6 mol, a=________ 。
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。n(NH3) __________。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)= _____ 。
(4)原混合气体中,a:b= 。
(5)将1molN2和3molH2合成NH3反应时,下列叙述能说明该反应已达到化学平衡状态的是(填标号)_________ ;
A、容器内的总压强不随时间而变化
B、反应后混合气体的密度不再发生变化
C、三种气体的浓度相等且保持不变
D、NH3的分解速率与生成速率相等
E、混合气体的平均相对分子质量不再发生变化
-
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生可逆反应:N2(g)+3H2(g)═2NH3(g).
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值.
(2)反应达到平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%,计算平衡时N2的转化率.
-
(10分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生可逆反应:N2(g)+3H2(g) ===== 2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,计算a的值。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%,计算平衡时N2 的转化率。
-
恒温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)⇌2NH3(g)
求:(1)反应进行到某时刻t时,n(N2)=13mol,n(NH3)=6mol,计算a=______
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%,计算平衡时NH3的物质的量,n(NH3)=______.
(3)原混合气体与平衡时混合气体的总物质的量之比(写出最简整数比,下同)n(始):n(平)=______
(4)原混合气体中,a:b=______
(5)达到平衡时,N2和H2的转化率之比,α(N2):α(H2)=______
(6)平衡混合气体中,n(N2):n(H2):n(NH3)=______.
-
在恒温下,将a mol N2与b mol H2的混合气体通入一个体积为V L固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(1) 若反应进行到某时刻t时,nt(N2)="13" mol,nt(NH3)="6" mol,计算a的值__________。
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量__________。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)
n(始)∶n(平)= __________。
(4)原混合气体中a∶b=__________。
(5) 达到平衡时,N2和H2的转化率之比α (N2)∶α (H2)= __________。
(6) 若反应达平衡用时为10分钟,用NH3表示从反应开始到平衡的化学反应速率 __________。
-
恒温下,将amolN2与bmH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)  2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值__________。
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数为25%。计算平衡时NH3的物质的量为_________________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n(始):n(平)=______。
(4)原混合气体中,a:b=______________。
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)=_____________。
-
恒温下,将amolN2与bmH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)  2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值__________。
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数为25%。计算平衡时NH3的物质的量为_________________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n(始):n(平)=______。
(4)原混合气体中,a:b=______________。
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)=_____________。
2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
4NO2(g)+O2(g),ΔH>0
