-
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
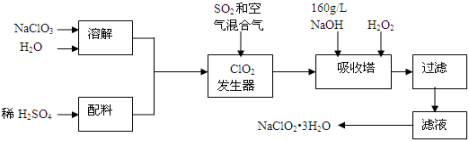
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2•3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(1)发生器中鼓入空气的作用可能是 。
a.将SO2氧化成SO3,增强酸性
b.将NaClO3还原为ClO2
c.稀释ClO2以防止爆炸
(2)吸收塔内发生反应的化学方程式为 。
(3)吸收塔中为防止NaClO2被还原成NaCl,需加的试剂可以选用的是 (填序号)。
a.Na2O2 b.Na2S c.FeCl2
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是 。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 ml待测溶液。(已知:ClO2+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00 ml待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V ml 。(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为 。
②该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,结果化成最简)
-
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
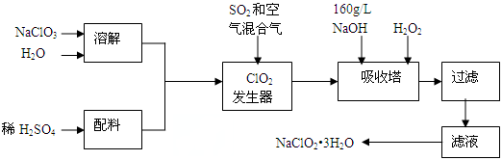
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2•3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(1)发生器中发生反应的离子方程式为 。发生器中鼓入空气的作用可能是 。
A.将SO2氧化成SO3,增强酸性
B.将NaClO3还原为ClO2
C.稀释ClO2以防止爆炸
(2)吸收塔内发生反应的化学方程式为 ;吸收塔内的温度不能超过20℃,其目的是 。
(3)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。以下还可以选择的还原剂是 (选填序号)。
A.Na2O2 B.Na2S C.FeCl2
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是_____________________。
-
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
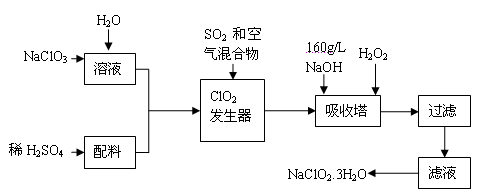
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2 3H2O。
3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③HClO2可看成是强酸。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个量是 (用文字说明)。
(2)发生器中鼓入二氧化硫的作用可能是 (填序号)。
A.将SO2氧化成SO3,增强酸性 B.稀释ClO2以防止爆炸;
C.将NaClO3还原成ClO2
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(4)吸收塔内的反应的化学方程式为 。吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式:________。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (填序号)。
A.Na2S B.Na2O2 C.FeCl2
(6)从滤液中得到NaClO2 3H2O粗晶体的实验操作依次是 (填序号)。
3H2O粗晶体的实验操作依次是 (填序号)。
A.蒸发 B.蒸馏 C.冷却结晶 D.灼烧 E.过滤
要得到更纯的NaClO2 3H2O晶体能否加热蒸干 (填“能”或“不能”)。
3H2O晶体能否加热蒸干 (填“能”或“不能”)。
-
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖的漂白和杀菌,其一种生产工艺流程如下:
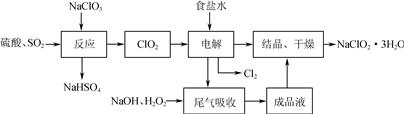
回答下列问题:
(1) 写出“反应”步骤中生成ClO2的化学方程式:________________________。
(2) “电解”所用食盐水由粗盐水精制而成,精制时为除去Mg2+和Ca2+,要加入的试剂分别为___________________、___________________。
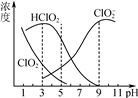
(3) 亚氯酸钠(NaClO2)在水溶液中可生成ClO2、HClO2、ClO 、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH________(填“大于”“ 等于”或“小于”)3。
、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH________(填“大于”“ 等于”或“小于”)3。
(4) 为了测定NaClO2·3H2O的纯度,取上述合成产品10.00 g溶于水配成1000 mL溶液,取出20.00 mL溶液于锥形瓶中,再加入足量硫酸酸化的KI溶液,充分反应后加入2~3滴淀粉溶液,用0.2640 mol·L-1Na2S2O3标准溶液滴定,共用去Na2S2O3标准溶液20.00 mL,通过计算确定该产品纯度是否合格?(合格纯度在90%以上)(写出计算过程)__________
提示: 2Na2S2O3+I2===Na2S4O6+2NaI。
-
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图:
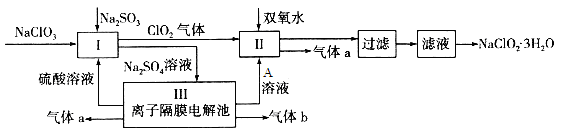
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-36;Ksp(PbS)=8×10-28
③Ⅲ装置中电解硫酸钠溶液,阳极区生成氧气同时产生硫酸,阴极区生成氢气同时产生氢氧化钠。
(1) I中发生反应的离子方程式为 ____________。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为 (用化学式表示);
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
(4)Ⅲ装置中若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为________。
-
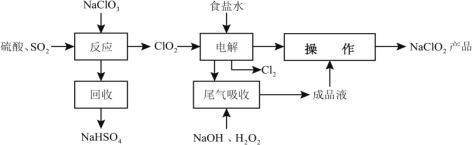
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,同时也是对烟气进行脱硫、脱硝的吸收剂。其一种生产工艺如下:
已知:
纯ClO2易分解爆炸,空气中 ClO2的体积分数在 10%以下比较安全;
NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
NaClO2饱和溶液在温度低于 38℃时析出 NaClO2∙3H2O,等于或高于38℃时析出 NaClO2,高于 60℃时分解成 NaClO3和 NaCl。回答下列问题:
(1)写出“反应”步骤中生成 ClO2的化学方程式_________。
(2)从滤液中得到的 NaClO2•3H2O 晶体的方法是_________。
(3)“尾气吸收”是吸收“电解”过程排出的少量 ClO2 。在尾气吸收过程中,可代替 H2O2的试剂是_________(填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(4)国家标准规定产品中优级纯试剂纯度≥99.8%,分析纯试剂纯度≥99.7%,化学纯试剂纯度≥99.5%。为了确定某批次 NaClO2产品的等级,研究小组设计测定方案如下:取 10.00g 样品,用适量蒸馏水溶解后,加入略过量的 KI 溶液;充分反应后,将反应液定容至 200mL, 取出 20.00mL 于锥形瓶;向锥形瓶中滴加两滴淀粉溶液,用 2.00mol•L﹣1的 Na2S2O3溶液与之反应,消耗Na2S2O3溶液 22.00mL。该样品可达试剂纯度 ________________。(写出计算过程) 已知: ClO2﹣+4I﹣+4H+═2H2O+2I2+Cl﹣ , I2+2S2O32﹣═2I﹣
-
过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等。某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验。
I.调查
(1)过氧化氢常用于消毒、杀菌、漂白等方面的主要原因是 。
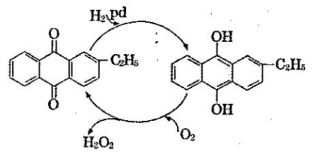
(2)制备过氧化氢目前最常用的是乙基蒽醌法,其主要过程可以用下图表示,此过程中与Pd起相同作用的物质为 (写名称)。
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对 H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中。
| 实验编号 | T/X | H202初始浓度/moL· L-1 | FeCl3初始浓度/ moL· L-1 moL· L-1L-1 |
| I | 20 | 1.0 | |
| II | 50 | 1.0 | 0 |
| III | 50 | | 0.1 |
①实验I、Ⅱ研究___________对分解速率的影响,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为 moL· L-1。
②三组实验中分解速率最慢的是 (填编号)。
III.过氧化氢含量的实验测定
兴趣小组同学用0.100 0 moL·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为 2MnO4- +5H2O2 +6H+ =2Mn2+ +8H2O+5O2↑
(4)滴定到达终点的现象是_ 。
(5)用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4 标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为__________moL·L-1 (保留三位有效数字)。
-
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
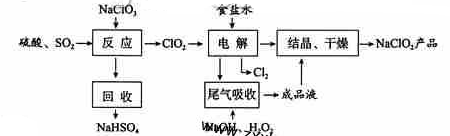
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
-
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等。其一种生产工艺如下:
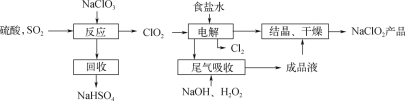
(1) 写出“反应”步骤中生成ClO2的化学方程式:_________________________________。
(2) “电解”中阴极反应的主要产物是____。
(3) “电解”所用食盐水由粗盐水精制而成。精制时,为除去Mg2+和Ca2+,要加入的试剂分别为______溶液、____溶液。(填化学式)
(4) “尾气吸收”是吸收“电解”过程排出的少量ClO2。写出“尾气吸收”的离子方程式:____。此吸收反应中,氧化剂与还原剂的物质的量之比为____。
(5) “有效氯含量”可用来衡量含氯消毒剂的消毒能力。其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____g(计算结果保留两位小数)。
-
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下:步骤一,利用NaClO3在硫酸作用下与SO2反应生成 ClO2和一种酸式盐。步骤二,将ClO2在NaOH溶液中与H2O2反应即可生成NaClO2
回答下列问题:
(1)NaClO2中Cl的化合价为_____________。
(2)写出步骤一中生成ClO2的化学方程式____________________
(3) 步骤二反应中氧化剂与还原剂的物质的量之比为_________________,该反应中氧化产物是____________________。
(4)亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为______________。
(5)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2 C.ClO2 D.O3
(6)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为________,H2O2被称为“绿色氧化剂”的理由是___________________。

3H2O。
3H2O粗晶体的实验操作依次是 (填序号)。
3H2O晶体能否加热蒸干 (填“能”或“不能”)。








