-
某反应2NH3 N2+3H2在三种不同条件下进行,N2、H2的起始浓度均为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
N2+3H2在三种不同条件下进行,N2、H2的起始浓度均为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
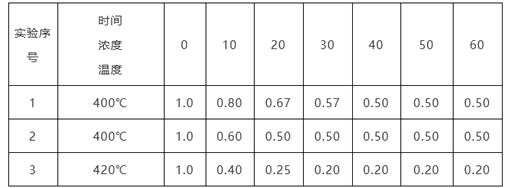
根据上述数据,回答下列问题:
(1)在实验1、2中,有一个实验使用了催化剂,它是______(填字母)。
A.实验1 B.实验2
(2)在实验3中,平衡时NH3的转化率为__________________。
(3)工业合成氨的反应如下:N2+3H2 2NH3。已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molNH3中的共价键放出的能量为1173kJ,则由N2和H2生成2molNH3过程中的能量变化为_______kJ。下图能正确表示该反应中能量变化的是______(填字母)。
2NH3。已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molNH3中的共价键放出的能量为1173kJ,则由N2和H2生成2molNH3过程中的能量变化为_______kJ。下图能正确表示该反应中能量变化的是______(填字母)。
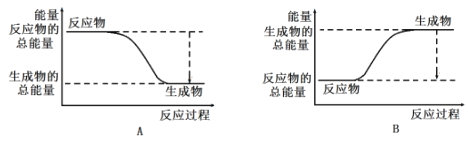
-
一定条件下发生反应N2 + 3H2  2NH3,在5 min内,N2的物质的量浓度由6 mol / L,变为2 mol / L,则用NH3表示该反应在这段时间的平均速率为
2NH3,在5 min内,N2的物质的量浓度由6 mol / L,变为2 mol / L,则用NH3表示该反应在这段时间的平均速率为
A. 4 mol / (L•min) B. 1.6 mol / (L•min) C. 0.8 mol / (L•min) D. 0.6 mol / (L•min)
-
在N2+3H2  2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在该段时间内用H2表示的平均反应速率为0.45mol/(L·s)。则反应所经过的时间是( )
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在该段时间内用H2表示的平均反应速率为0.45mol/(L·s)。则反应所经过的时间是( )
A.2s B.2 min C.3s D.3 min
-
在一定条件下N2 + 3H2⇌ 2NH3 的反应中,起始N2浓度为2mol/L,H2浓度为5mol/L, 反应到2分钟时,测得 NH3 的反应速率为v(NH3 )=0.4mol/(L·min),填空:
(1) NH3 的转化浓度为c(NH3 )=___________ mol/(L·min)
(2)三段式填空:
(mol/L) N2 + 3H2 ⇌ 2NH3
起始浓度 2 5 0
转化浓度 _ _ _
2min后浓度 _ _ _
(3)用v(N2)表示的反应速率为:v(N2)=__________mol/(L·min)
(4)用v(H2)表示的反应速率为:v(H2)=__________mol/(L·min)
-
一定条件下,对于可逆反应N2(g)+3H2(g)⇌2NH3(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1mol•L-1、0.3mol•L-1、0.08mol•L-1,则下列判断正确的是( )
A.C1:C2=1:3
B.平衡时,H2和NH3的生成速率之比为2:3
C.N2、H2的转化率之比为1:3
D.C1的取值范围为0.04mol•L-1<C1<0.14mol•L-1
-
已知某条件下,合成氨反应的数据如下:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
起始浓度/mol·L-1 1.0 3.0 0.2
2s末浓度/mol·L-1 0.6 1.8 1.0
4s末浓度/mol·L-1 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是 ( )
A.2s末氨气的反应速率=0.4mol·(L·s)-1
B.前2s时间内氨气的平均反应速率=0.4mol·(L·s)-1
C.前4s时间内氨气的平均反应速率=0.3mol·(L·s)-1
D.2~4s时间内氨气的平均反应速率=0.2mol·(L·s)-1
-
已知某条件下,合成氨反应的数据如下:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
起始浓度/mol·L-1 1.0 3.0 0.2
2s末浓度/mol·L-1 0.6 1.8 1.0
4s末浓度/mol·L-1 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是 ( )
A.2s末氨气的反应速率=0.4mol·(L·s)-1
B.前2s时间内氨气的平均反应速率=0.4mol·(L·s)-1
C.前4s时间内氨气的平均反应速率=0.3mol·(L·s)-1
D.2~4s时间内氨气的平均反应速率=0.2mol·(L·s)-1
-
已知某条件下,合成氨反应的数据如下:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
起始浓度/mol·L-1 1.0 3.0 0.2
2s末浓度/mol·L-1 0.6 1.8 1.0
4s末浓度/mol·L-1 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是( )
A.2s末氨气的反应速率=0.4mol·(L·s)-1
B.前2s时间内氨气的平均反应速率=0.4mol·(L·s)-1
C.前4s时间内氨气的平均反应速率=0.3mol·(L·s)-1
D.2s~4s时间内氨气的平均反应速率=0.2mol·(L·s)-1
-
一定条件下,对于可逆反应N2(g)+3H2(g) 2NH3(g),若N2、H2、NH3的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2NH3(g),若N2、H2、NH3的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A.C1:C2=1:3
B.平衡时,H2和NH3的生成速率之比为2:3
C.N2、H2的转化率之比为1:3
D.C1的取值范围为0.04 mol·L-1<C1<0.14 mol·L-1
-
一定条件下氨的分解反应2NH3 N2+3H2在容积为2 L的密闭容器内进行,已知起始时氨气的物质的量为4 mol,5 s末为2.4 mol,则用氨气表示该反应的速率为
N2+3H2在容积为2 L的密闭容器内进行,已知起始时氨气的物质的量为4 mol,5 s末为2.4 mol,则用氨气表示该反应的速率为
A. 0.32 mol·L-1·s-1 B. 0.16 mol·L-1·s-1
C. 1.6 mol·L-1·s-1 D. 0.8 mol·L-1·s-1
N2+3H2在三种不同条件下进行,N2、H2的起始浓度均为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。

 2NH3。已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molNH3中的共价键放出的能量为1173kJ,则由N2和H2生成2molNH3过程中的能量变化为_______kJ。下图能正确表示该反应中能量变化的是______(填字母)。
2NH3。已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molNH3中的共价键放出的能量为1173kJ,则由N2和H2生成2molNH3过程中的能量变化为_______kJ。下图能正确表示该反应中能量变化的是______(填字母)。