-
辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:

已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
回答下列问题
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式__________。
(2)调节pH的目的是___________,pH的调节范围为___________。
(3)生成MnCO3沉淀的离子方程式为___________。
(4)操作A为___________。
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2(g)═ 2Cu2O(s)+ 2SO2(g)△H=﹣768.2kJ/mol
2Cu2O(s)+ Cu2S(s)═ 6Cu(s)+ SO2(g)△H=" +116.0" kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为___________。
(6)若用含85% Cu2S(Mr=160)的辉铜矿来制备无水Cu(NO3)2,假设浸取率为95%,调节pH时损Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.6 kg这样的辉铜矿最多能制备__________mol无水Cu(NO3)2。(计算结果精确到小数点后1位)
-
辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:

已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol.L-1计算)。
| 离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
回答下列问题:
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式 。
(2)调节pH的目的是 ,pH的调节范围为_____________。
(3)生成MnCO3沉淀的离子方程式为 。
(4)操作A为 。
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2 (g) =2Cu2O(s)+2SO2(g) △H=- 768.2 kJ.mol-l
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2 (g) △H=+116.0 kJ.mol-l
则由Cu2S与O2加热反应生成Cu的热化学方程式为_____________。
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(NO3)2。假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.0 kg这样的辉铜矿最多能制备 kg无水Cu(NO3)2。
-
辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:
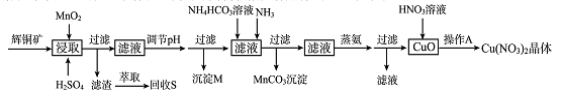
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
回答下列问题
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式 。
(2)调节pH的目的是 ,pH的调节范围为 。
(3)生成MnCO3沉淀的离子方程式为 。
(4)操作A为 。
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2(g)═ 2Cu2O(s)+ 2SO2(g)△H=﹣768.2kJ/mol
2Cu2O(s)+ Cu2S(s)═ 6Cu(s)+ SO2(g)△H= +116.0 kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为 。
(6)若用含85% Cu2S(Mr=160)的辉铜矿来制备无水Cu(NO3)2,假设浸取率为95%,调节pH时损Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.6 kg这样的辉铜矿最多能制备 mol无水Cu(NO3)2。(计算结果精确到小数点后1位)
-
碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿(Cu2S,含有SiO2和少量Fe2O3等杂质)为原料制备碱式碳酸铜的流程如图所示:

已知:①有关金属离子形成氢氧化物沉淀的pH范围如下:

②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有___(任写一种)。
(2)滤渣I经CS2提取后可获得一种淡黄色副产品,则滤渣I中的主要成分是___(填化学式)。回收淡黄色副产品过程中温度控制在50~60℃之间,不宜过高或过低的原因是___。
(3)常温下“除铁”时加入的试剂A可用CuO,调节pH的范围为___,若加A后将溶液的pH调为5,则溶液中Fe3+的浓度为___ mol/L。
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式:___。
(5)“赶氨”时,最适宜的操作方法是___。
(6)测定副产品MnSO4·H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为___(保留到小数点后两位)。
-
(13分)安徽繁昌矿产资源十分丰富,其中峨山镇的随山主产辉铜矿。辉铜矿石主要含有硫化亚铜(Cu2S)、脉石(SiO2)和少量的银。孙村富铁矿业开发集团采用现代湿法炼铜工艺,用酸浸法从矿石中提取铜,其主要工艺流程图如下:

(1)矿泥的主要成分是______.
(2) 反应1中发生的离子方程式是______.
(3) 第一次萃取实验结束时,发现水层1的颜色仍然较蓝,接下来的操作是______
(4) 反萃取剂的作用是______。
(5) 反应2是用惰性电极电解水层2,写出阳极发生的反应方程式__________________
(6) 传统的湿法炼铜工艺是:粉碎矿石,先高温灼烧,加酸溶解产物,然后加人铁屑进一步得到铜。请评价两种工艺的优缺点________________________
-
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
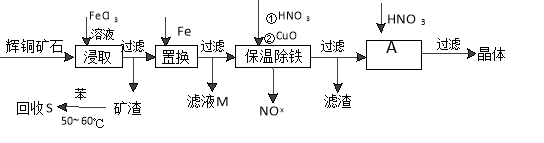
(1)写出浸取过程中Cu2S溶解的离子方程式 。
(2)回收S过程中温度控制在50℃~60℃之间,不宜过高或过低的原因是 、 。
(3)保温除铁过程中加入CuO的目的是 。
(4)A步操作为 要用硝酸调节溶液的pH,其理由是 。
-
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:(已知:硫不溶于水,微溶于酒精,易溶于二硫化碳、四氯化碳和苯。)
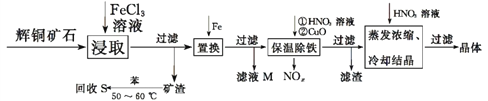
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:____________。
(2)“回收S”过程中温度控制在50~60 ℃之间,不宜过高或过低的原因是_____________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为_________________。向“滤液M”中加入(或通入)____(填字母),可得到另一种可循环利用的物质。 a.铁 b.氯气 c.高锰酸钾
(4)“保温除铁”过程中,加入CuO的目的是__________________;“蒸发浓缩、冷却结晶”过程中,加入HNO3调节溶液的pH,其理由是___________。
(5)洗涤硝酸铜晶体的洗涤剂可以使用下列物质中的______________。
a.酒精 b.热水 c.饱和硝酸铜溶液
-
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2).一种以辉铜矿石为原料制备硝酸銅的工艺流程如下所示:
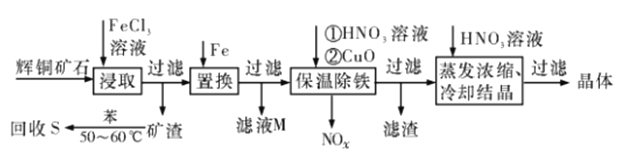
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:_________。
(2)“矿渣”中除了S以外,还有_______(填化学式);“回收S”"过程中温度控制在50~60℃之间,不宜过高或过低的原因是_________ 。
(3)“保温除铁”过程中,加入CuO的目的是_________;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由是_________ 。
(4)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________________;向“滤液M”"中加入(或通入) ________ (填字母代号),可得到另一种流程中可循坏利用的物质。
A.铁 B.氯气 C.高锰酸钾
-
(12分)辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
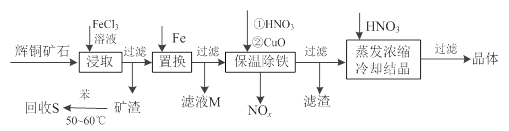
(1)写出浸取过程中Cu2S溶解的离子方程式________。
(2)回收S过程中温度控制在50℃~60℃之间,不宜过高或过低的原因是________、 ________。
(3)气体NOx 与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________;向滤液M中加入(或通入)下列________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)保温除铁过程中加入CuO的目的是________;蒸发浓缩时,要用硝酸调节溶液的pH,其理由是________。
-
(12分)辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
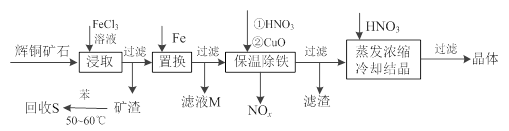
(1)写出浸取过程中Cu2S溶解的离子方程式________。
(2)回收S过程中温度控制在50℃~60℃之间,不宜过高或过低的原因是________、 ________。
(3)气体NOx 与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________;向滤液M中加入(或通入)下列________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)保温除铁过程中加入CuO的目的是________;蒸发浓缩时,要用硝酸调节溶液的pH,其理由是________。










