-
(16分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
⑴实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:____________________________________。
⑵下图是某笔记本电脑用甲醇燃料电池的结构示意图。
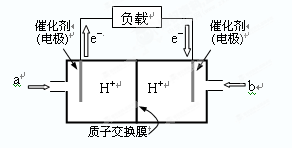
放电时甲醇应从______处通入(填“a”或“b”),电池内部H+向_____(填“左”或“右”)移动。写出电池负极的电极反应式:_______________________________。
⑶由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键
H-H
N-H
N≡N
键能/kJ·mol-1
436
a
945
已知反应N2(g)+3H2(g)
2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a 的数值:_______________。
⑷依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算2C(s,石墨)+H2(g)=C2H2(g)反应的焓变△H =________。
高二化学填空题简单题查看答案及解析
-
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出a kJ的热量,试写出表示甲烷燃烧热的热化学方程式: __;
(2)已知反应CH3—CH3(g)→ CH2===CH2(g)+H2(g),有关化学键的键能如下:
化学键
C—H
C===C
C—C
H—H
键能/kJ·mol-1
414.4
615.3
347.3
435.3[XK]
通过计算得出该反应的反应热为 ;
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2 599 kJ·mol-1
根据盖斯定律,计算25OC时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的焓变:ΔH=_ 。
高二化学填空题困难题查看答案及解析
-
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5 g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,试写出甲醇燃烧的热化学方程式:__________________________。
(2)由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键
H—H
N—H
N≡N
键能/(kJ • mol−1)
436
391
945
已知反应N2+3H2
2NH3 ΔH=a kJ • mol−1。
试根据表中所列键能数据估算a的数值:______________________。
(3)盖斯定律告诉我们化学反应的能量变化和反应的过程无关,只与反应的终态和始态有关,依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)
CO2(g) ΔH1=−393.5 kJ • mol−1
2H2(g)+O2(g)
2H2O(l) ΔH2 =−571.6 kJ • mol−1
2C2H2(g)+5O2(g)
4CO2(g)+2H2O(l) ΔH3 =−2 599 kJ • mol−1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的焓变_______________。
高二化学填空题中等难度题查看答案及解析
-
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式________;
(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.已知热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);△H=+19kJ/mol
写出FeO(s)被CO还原成Fe和CO2的热化学方程式________;
(3)甲醇是一种清洁高效的能源,若将甲醇、氧气和氢氧化钾溶液设计成燃料电池,该电池正极反应式为:________.高二化学填空题中等难度题查看答案及解析
-
(6分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式_________________。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键
H-H
N-H
N≡N
键能/kJ·mol-1
436
391
945
已知反应N2+3H2
2NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a的数值为________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+02(g)=C02(g) △H1=-akJ·mol-1
2H2(g)+02(g)=2H20(l) △H2=-bkJ·mol-1
2C2H2(g)+502(g)=4C02(g)+2H20(l) △H3=-ckJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变 :△H=_________。
高二化学填空题简单题查看答案及解析
-
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得:5g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5 kJ的热量。试写出甲醇燃烧的热化学方程式:________________________________________________________。
(2)由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
化学键
H—H
N—H
N≡N
键能/kJ·mol-1
436
391
945
已知反应N2+3H2===2NH3 ΔH=a kJ·mol-1。试根据表中数据计算a的数值为________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式:
____________________________________________________________________________。
高二化学计算题中等难度题查看答案及解析
-
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,3.2g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出72.64kJ的热量,试写出甲醇燃烧的热化学方程式:______________________
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键
H-H
N-H
N≡N
键能/kJ·mol-1
436
391
945
已知反应N2(g)+3H2(g) =2NH3(g),△H=x kJ·mol-1。试根据表中所列键能数据估算△H为________________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知下列反应的热化学方程式为:
① C(s)+O2(g)=CO2(g) △H1= -akJ/mol
② CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H2= -bkJ/mol
③ H2(g)+1/2O2(g)=H2O(l) △H3= -ckJ/mol
试计算下列反应的反应热:2C(s)+2H2(g)+O2(g)=CH3COOH(l)
△H=____________________________(用含a、b、c的字母表示)
高二化学填空题中等难度题查看答案及解析
-
(10分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1) 实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则甲醇的标准燃烧热ΔH=________。
(2)今有如下两个热化学方程式:则a________b(填“>”、“=”或“<”)
H2(g)+ 1/2O2(g)=H2O(g) ΔH1=a kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(l) ΔH2=b kJ·mol-1
(3)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键
H-H
N-H
N≡N
键能/kJ·mol-1
436
391
945
已知反应N2(g)+3H2(g)
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________(注明“+”或“-”)。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)
CH3OCH3(g) + CO2 (g)的ΔH= ________;
高二化学填空题简单题查看答案及解析
-
(10分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1) 实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则甲醇的燃烧热ΔH=________。
(2)今有如下两个热化学方程式:则a________b(填>, = , <)
H2(g)+
O2(g) = H2O(g) ΔH1=a kJ·mol-1
H2(g)+
O2(g) = H2O(l) ΔH2=b kJ·mol-1
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键
H-H
N-H
N≡N
键能/kJ·mol-1
436
391
945
已知反应N2(g)+3H2(g)
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:________(写出 + 或-)。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(s)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s)和H2(g)生成1mol C2H2(g)反应的反应热△H =________。
高二化学填空题简单题查看答案及解析
-
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程为: .
(2)今有如下两个热化学方程式:则a b(填“>”、“=”或“<”)
2H2(g)+O2(g)=2H2O(g)△H1=a kJ•mol﹣1
2H2(g)+O2(g)=2H2O(l)△H2=b kJ•mol﹣1
(3)
化学键
H﹣H
N﹣H
N≡N
键能/kJ•mol﹣1
436
391
945
已知反应N2(g)+3H2(g)═2NH3(g)△H=a kJ•mol﹣1.试根据表中所列键能数据估算a 的值: (注明“+”或“﹣”).
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g)△H=﹣90.8kJ•mol﹣1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=﹣23.5kJ•mol﹣1
③CO(g)+H2O(g)═CO2(g)+H2(g)△H=﹣41.3kJ•mol﹣1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H= .
高二化学填空题简单题查看答案及解析