-
砷(As)是第四周期第VA族的元素,能形成多种化合物。回答下列问题:
(1)同族元素的同类物质结构相似,AsH3的电子式为_______。
(2)已知H3AsO3溶于水后的电离方程式为As3++30H- H3AsO3
H3AsO3 3H++AsO33-。H3AsO3中砷的化合价为______;若分别向上述平衡体系中加人稀硫酸、NaOH 溶液,则生成的正盐的化学式分别为______、_____。
3H++AsO33-。H3AsO3中砷的化合价为______;若分别向上述平衡体系中加人稀硫酸、NaOH 溶液,则生成的正盐的化学式分别为______、_____。
(3)已知I2、AsO33-、I-、AsO43-之间存在如下转化:I2 + AsO33-+2OH- 2I-+AsO43-+H2O。为验证该反应具有可逆性,某同学将等物质的量浓度的碘水与Na3AsO3溶液按体积比为V1: V2的比例混合(另加入适量的碱)。当V1_____V2(填“>”或“<”) 时,只用_____就可以确定该反应具有可逆性。
2I-+AsO43-+H2O。为验证该反应具有可逆性,某同学将等物质的量浓度的碘水与Na3AsO3溶液按体积比为V1: V2的比例混合(另加入适量的碱)。当V1_____V2(填“>”或“<”) 时,只用_____就可以确定该反应具有可逆性。
(4)常温下,将浓度均为2a mol·L-1的KI、Na3AsO4 溶液等体积混合后,溶液存在如下可逆反应:2I-(aq)+AsO43-(aq)+H2O(1) I2(aq)+AsO33-(aq)+2OH-(aq),通过调整溶液的pH(加适量碱)来控制反应进行的方向。下图是反应中c ( AsO33-)与时间t的关系图:
I2(aq)+AsO33-(aq)+2OH-(aq),通过调整溶液的pH(加适量碱)来控制反应进行的方向。下图是反应中c ( AsO33-)与时间t的关系图:
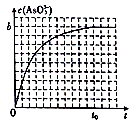
① 反应达到平衡后,向溶液中加人少量固体NaOH,则重新达到平衡后,溶液中AsO43-的转化率______(填“增大”、“减小”或 “不变”) , c(OH-)__________(填“增大”、“减小”或“不变”)。
② 若t0时刻,溶液的Ph=8,则该反应的平衡常数K=__________。
(5)若使2I-(aq)+AsO43-(aq)+H2O(1) I2(aq)+AsO33-(aq)+2OH-(aq)以原电池的方式进行,则正极的电极反应式为___________。
I2(aq)+AsO33-(aq)+2OH-(aq)以原电池的方式进行,则正极的电极反应式为___________。
-
五种短周期元素A、B、C、D、E、F的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E、F均能形成共价化合物。A和B形成的化合物在水中呈碱性。回答下列问题:
(1)五种元素中,原子半径最大的元素在周期表中的位置:__________________,非金属性最强的元素其原子结构示意图为:__________________________;
(2)能说明E、F非金属性强弱的事实是___________________(用一个化学方程式举例);
(3)用电子式表示C、E元素组成的化合物的形成过程:____________________________;
(4)由A和B、D、E、F所形成的共价化合物中,热稳定性最差的是_______(用化学式表示);
(5)D在不充足的F中燃烧,生成的主要产物的结构式为_________________________;
(6)A和F形成的化合物与A和B形成的化合物反应,产物的电子式为_________________,其中存在的化学键类型为___________________________;
(7)写出F的同主族短周期元素的单质与水反应的化学方程式___________________________。
-
砷及其化合物被运用在农药、除草剂、杀虫剂与多种合金中,其中三氧化二砷(AS2O3)被称为砒霜,是一 种毒性很强的物质。回答下列问题:
(1)As在元素周期表中的位置是_____________,AsH3的电子式_________。
(2)一定条件下,雄黄(As4S4)与As2O3的转化关系如图所示。若该反应中1mol As4S4(其中As元素的化合价为+2)参加反应时,转移28mole-,则物质a为_________(填化学式)。

(3)焦炭真空冶炼砷时需加入催化剂,其中部分反应的热化学方程式如下:
反应 I .As2O3(g) +3C(s)  2As(g) +3CO(g)
2As(g) +3CO(g)  =a kJ· mol-1
=a kJ· mol-1
反应 II.As2O3(g) +3C(s) 
 As4(g) +3CO(g)
As4(g) +3CO(g)  =b kJ ·mol-1
=b kJ ·mol-1
反应III.As4(g)  4As(g)
4As(g) 
①  =_________kJ ·mol-1 (用含a,b的代数式表示)。
=_________kJ ·mol-1 (用含a,b的代数式表示)。
②反应中催化剂的活性会因为反应II[生成As4(g)]的发生而降低,同时存在的反应III可使As4(g)的量减少。已知催化剂X、Y的相关数据如表所示:
| 反应II | 反应III |
| 活化能/ (kJ ·mol -1 ) | 催化剂X | 56 | 75 |
| 催化剂Y | 37 | 97 |
由表中数据判断催化剂X_______ (填“优于”或“劣于”)催化剂Y。
(4)298 K 时,将 20mL 3xmol·L-1 Na3AsO3溶液、20 ml 3xmol·L-l I2溶液和 20mL 6xmol· L-l NaOH 溶液混合(忽略溶液体积变化),发生反应: (aq) +I2(aq) +2OH-(aq)
(aq) +I2(aq) +2OH-(aq)
 (aq) +2I-(aq) +H2O(l)。溶液中 c(
(aq) +2I-(aq) +H2O(l)。溶液中 c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
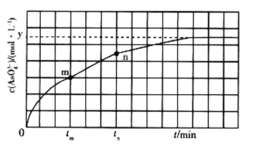
①下列可说明反应达到平衡的是_______ (填标号)。
a.v(I- ) =2v( )
)
b.溶液的c(OH-)不再发生变化
c.c(I-) =ymol· L-1
d.c( )/c(
)/c( )不再发生变化
)不再发生变化
e.c(Na+) =5xmol· L-1
②tm min时,v正( )_______ (填“大于”“小于”或“等于”)v逆(
)_______ (填“大于”“小于”或“等于”)v逆(  )。
)。
③tm min时v逆(  ) _______ (填“大于”“小于”或“等于”)tn时v逆(
) _______ (填“大于”“小于”或“等于”)tn时v逆(  ),理由是___________________。
),理由是___________________。
-
元素周期律知识同族元素所形成的同一类型的化合物,其结构和性质都相似。化合物PH4I是一种白色晶体,下列对它的描述中不正确的是( )
A.它是一种共价化合物
B.在加热时此化合物可以分解为PH3和HI或H2和I2
C.这种化合物能跟碱反应
D.该化合物可以由PH3和HI化合而成
-
元素周期律知识同族元素所形成的同一类型的化合物,其结构和性质都相似。化合物PH4I是一种白色晶体,下列对它的描述中不正确的是( )
A.它是一种共价化合物
B.在加热时此化合物可以分解为PH3和HI或H2和I2
C.这种化合物能跟碱反应
D.该化合物可以由PH3和HI化合而成
-
a、b、c、d为短周期元素,a的原子中只有1个电子,b2−和C+离子的电子层结构相同,d与b同族。下列叙述错误的是
A.a与其他三种元素形成的二元化合物中其化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d和a形成的化合物的溶液呈弱酸性
-
a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+离子的电子层结构相同,d与b同族。下列叙述错误的是
A. a与其他三种元素形成的二元化合物中其化合价均为+1
B. b与其他三种元素均可形成至少两种二元化合物
C. c的原子半径是这些元素中最大的
D. d和a形成的化合物的溶液呈弱酸性
-
a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和C+离子的电子层结构相同,d与b同族。下列叙述错误的是
A. a与其他三种元素形成的二元化合物中其化合价均为+1
B. b与其他三种元素均可形成至少两种二元化合物
C. c的原子半径是这些元素中最大的
D. d和a形成的化合物的溶液呈弱酸性
-
短周期元素X、Y、Z原子序数和为36,X、Y在同一周期,X+、Z2-具有相同的核外电子层结构。下列推测不正确的是
A. 同周期元素中X的金属性最强 B. X、Z形成的化合物只含有离子键
C. 同族元素中Z的氢化物稳定性最高 D. 同周期元素中Y的最高价含氧酸的酸性最强
-
a、b 、c 、d为短周期元素,a的原子中只有1个电子,b2-和c+离子的电子层结构相同,d与b同族。下列叙述错误的是( )
A. d与a形成的化合物的溶液呈弱酸性
B. a与其他三种元素形成的化合物中其化合价均为+1
C. c的原子半径是这些元素中最大的
D. b与其他三种元素均可形成至少两种化合物
H3AsO3
3H++AsO33-。H3AsO3中砷的化合价为______;若分别向上述平衡体系中加人稀硫酸、NaOH 溶液,则生成的正盐的化学式分别为______、_____。
2I-+AsO43-+H2O。为验证该反应具有可逆性,某同学将等物质的量浓度的碘水与Na3AsO3溶液按体积比为V1: V2的比例混合(另加入适量的碱)。当V1_____V2(填“>”或“<”) 时,只用_____就可以确定该反应具有可逆性。
I2(aq)+AsO33-(aq)+2OH-(aq),通过调整溶液的pH(加适量碱)来控制反应进行的方向。下图是反应中c ( AsO33-)与时间t的关系图:

I2(aq)+AsO33-(aq)+2OH-(aq)以原电池的方式进行,则正极的电极反应式为___________。

