-
二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①

②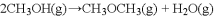

③

回答下列问题:
(1)反应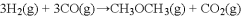 的
的 =_________
=_________ 。
。
(2)在不同温度下,按照相同物质的量投料,发生反应①。测得CO的平衡转化率与“压强的关系如图1所示,下列说法正确的是________(填序号).
A.反应温度: 
B.混合气体密度: 
C.混合气体平均摩尔质量: 
D.反应容器的体积关系: 
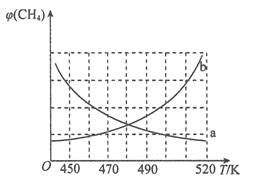
(3)采用一种新型的催化剂(主要成分是Cu-Mn合金),利用CO和H2制备二甲醚(DME)。由图2可知,催化剂中 约为______时最有利于二甲醚的合成。
约为______时最有利于二甲醚的合成。
(4)高温时二甲醚蒸气发生分解反应:  。迅速将二甲醚引人一个504℃的抽成真空的瓶中,在不同时刻测定瓶内压强p总如下表:
。迅速将二甲醚引人一个504℃的抽成真空的瓶中,在不同时刻测定瓶内压强p总如下表:

①该反应达到平衡状态时,二甲醚的转化率为___________。
②该反应的平衡常数Kp=_____。(用平衡分压代替平衡浓度计算,分压=总压X物质的量分数)
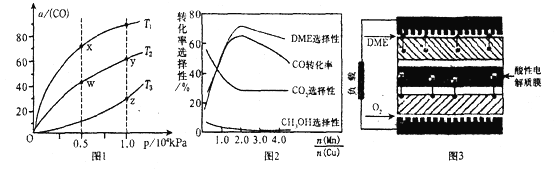
(5)一种以二甲醚作为燃料的燃料电池的工作原理如图3所示。其负极的电极反应式为___________。
-
二甲醚又称甲醚,简称 DME,熔点 ,沸点
,沸点 ,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(
,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气( )制备二甲醚的反应原理如下:
)制备二甲醚的反应原理如下:
①
②
回答下列问题:
(1)已知: ,若由合成气(
,若由合成气( ) 制备
) 制备  ,且生成
,且生成 ,其热化学方程式为_______________。
,其热化学方程式为_______________。
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入 和
和 . 5min达到平衡,平衡时测得
. 5min达到平衡,平衡时测得 ,
, ,此时
,此时 的转化率为___________。用
的转化率为___________。用  表示反应①的速率是_____________
表示反应①的速率是_____________ ,可逆反应②的平衡常数
,可逆反应②的平衡常数  =_______________________
=_______________________
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数 值变小,则下列说法正确的是_________________ 。
值变小,则下列说法正确的是_________________ 。
A. 平衡向正反应方向移动
B. 平衡移动的原因是升高了温度
C. 达到新平衡后体系的压强不变
D. 容器中 的体积分数减小
的体积分数减小
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入 和
和 进行反应①,平衡时
进行反应①,平衡时 和
和 的转化率如图所示,则a=________ (填数值)。
的转化率如图所示,则a=________ (填数值)。
(5)用活性炭还原法处理氮氧化物的有关反应为: 。向恒容密闭容器中加入一定量的活性炭和
。向恒容密闭容器中加入一定量的活性炭和 ,恒温(
,恒温( )时,各物质的浓度随时间的变化如下表:
)时,各物质的浓度随时间的变化如下表:
| 浓度/ 时间/min | 
| 
| 
|
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
在31 min时,若只改变某一条件使平衡发生移动,40 min,50 min时各物质的浓度如上表所示,则改变的条件是__________________。
在51 min时,保持温度和容器体积不变再充入 和
和 ,使二者的浓度均增加至原来的两倍,此时化学平衡__(填“正向移动”、“逆向移动”或“不移动”)。
,使二者的浓度均增加至原来的两倍,此时化学平衡__(填“正向移动”、“逆向移动”或“不移动”)。
-
二甲醚又称甲醚,简称DME,熔点 ,沸点
,沸点 ,与石油液化气
,与石油液化气 相似,被誉为“21世纪的清洁燃料”。制备原理如下:
相似,被誉为“21世纪的清洁燃料”。制备原理如下:
(I)由天然气催化制备二甲醚:① ;
;
(II)由合成气制备二甲醚:
②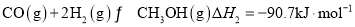 ;
;
③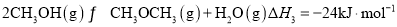 。
。
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是 和
和 ;
; 液态水变为气态水要吸收
液态水变为气态水要吸收 的热量。则
的热量。则 ________
________ 。
。
(2)反应③的化学平衡常数表达式为 ________。制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按
________。制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按 混合,图中能正确反映反应①中
混合,图中能正确反映反应①中 的平衡体积分数随温度变化的曲线是________。下列能表明反应①达到化学平衡状态的是________
的平衡体积分数随温度变化的曲线是________。下列能表明反应①达到化学平衡状态的是________ 填字母
填字母 。
。
A.混合气体的密度不变
B.反应容器中二甲醚的百分含量不变
C.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
D.混合气体的压强不变
(3)有人模拟制备原理Ⅱ,在500K时的2L的密闭容器中充入2molCO和 ,此时体系总压强是
,此时体系总压强是 。8min达到平衡,平衡时CO浓度为
。8min达到平衡,平衡时CO浓度为 ,
, ,则CO的转化率为________,用平衡分压表示可逆反应③的平衡常数
,则CO的转化率为________,用平衡分压表示可逆反应③的平衡常数 ________
________ 分压
分压 总压
总压 物质的量分数
物质的量分数 。
。
(4)在500K时的2L的密闭容器中充入 ,发生反应③,容器的总压强为4000kPa,反应5min后达到平衡,
,发生反应③,容器的总压强为4000kPa,反应5min后达到平衡, ,用单位时间甲醇的分压变化表示该反应的反应速率为________。
,用单位时间甲醇的分压变化表示该反应的反应速率为________。
-
二甲醚又称甲醚,简称 DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g)  CH3OH(g) △H1=-90.0kJ·mo l -1
CH3OH(g) △H1=-90.0kJ·mo l -1
②2 CH3OH(g)  CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1
回答下列问题:
(1)已知:H2O(1) =H2O(g) △H= +44.0kJ/mol,若由合成气(CO、H2) 制备 1molCH3OCH3(g),且生成 H2O(1),其热化学方程式为_______________。
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入2mol CO和6molH2,5min达到平衡,平衡时测得c(H2)=1.8mo l·L-1, c(CH3OCH3)=0.2mo l·L-1,此时 CO的转化率为__________。用 CH3OH 表示反应①的速率是_____________mo l·L-1·m i n -1,可逆反应②的平衡常数 K2=______________________。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数 K2 值变小,下列说法正确的是____。
A. 平衡向正反应方向移动 B. 平衡移动的原因是升高了温度
C. 达到新平衡后体系的压强不变 D. 容器中 CH3OCH3 的体积分数减小
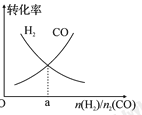
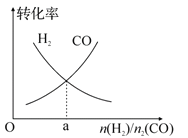
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入 CO(g)和 H2(g)进行反应①,平衡时 CO(g)和 H2(g)的转化率如图所示,则a=________ (填数值)。
(5)绿色电源“二甲醚燃料电池”的结构如图所示,电解质为 熔 融 态 的 碳 酸 盐 (如 熔 融K2CO3),其中 CO2 会参与电极反应。 工作时正极的电极反应为______________ 。

-
二甲醚又称甲醚,简称 DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g)  CH3OH(g) △H1=-90.0kJ·mo l -1
CH3OH(g) △H1=-90.0kJ·mo l -1
②2 CH3OH(g)  CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1
回答下列问题:
(1)已知:H2O(1) =H2O(g) △H= +44.0kJ/mol,若由合成气(CO、H2) 制备 1molCH3OCH3(g),且生成 H2O(1),其热化学方程式为_______________。
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入2mol CO和6molH2,5min达到平衡,平衡时测得c(H2)=1.8mo l·L-1, c(CH3OCH3)=0.2mo l·L-1,此时 CO的转化率为__________。用 CH3OH 表示反应①的速率是_____________mo l·L-1·m i n -1,可逆反应②的平衡常数 K2=______________________。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数 K2 值变小,下列说法正确的是____。
A. 平衡向正反应方向移动 B. 平衡移动的原因是升高了温度
C. 达到新平衡后体系的压强不变 D. 容器中 CH3OCH3 的体积分数减小
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入 CO(g)和 H2(g)进行反应①,平衡时 CO(g)和 H2(g)的转化率如图所示,则a=________ (填数值)。
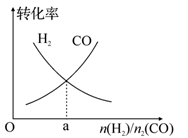
(5)绿色电源“二甲醚燃料电池”的结构如图所示,电解质为 熔 融 态 的 碳 酸 盐 (如 熔 融K2CO3),其中 CO2 会参与电极反应。 工作时正极的电极反应为______________ 。
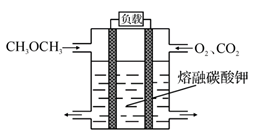
-
二甲醚又称甲醚,简称 DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g)  CH3OH(g) △H1=-90.0kJ·mo l -1
CH3OH(g) △H1=-90.0kJ·mo l -1
②2 CH3OH(g)  CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1
回答下列问题:
(1)已知:H2O(1) =H2O(g) △H= +44.0kJ/mol,若由合成气(CO、H2) 制备 1molCH3OCH3(g),且生成 H2O(1),其热化学方程式为___________________________________。
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入2mol CO和6molH2,5min达到平衡,平衡时测得c(H2)=1.8mo l·L-1, c(CH3OCH3)=0.2mo l·L-1,此时 CO的转化率为__________。可逆反应②的平衡常数 K2=_____________________ _。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数 K2 值变小,下列说法正确的是________________________。
A. 平衡向正反应方向移动 B. 平衡移动的原因是升高了温度
C. 达到新平衡后体系的压强不变 D. 容器中 CH3OCH3 的体积分数减小
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入 CO(g)和 H2(g)进行反应①,平衡时 CO(g)和 H2(g)的转化率如图1所示,则a=________ (填数值)。
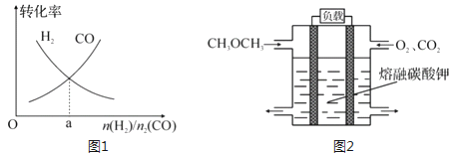
(5)绿色电源“二甲醚燃料电池”的结构如图 2 所示,电解质为 熔 融 态 的 碳 酸 盐 (如 熔 融K2CO3),其中 CO2 会参与电极反应。 工作时负极的电极反应为______________ 。
(6)对于反应CO(g) + H2O(g)  CO2(g) + H2(g) △H1= + 41.2kJ/mol在一个绝热的固定容积的容器中,判断此反应达到平衡的标志是______________。
CO2(g) + H2(g) △H1= + 41.2kJ/mol在一个绝热的固定容积的容器中,判断此反应达到平衡的标志是______________。
①体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变 ⑤体系的温度不再发生变化 ⑥υ(CO2)正=υ(H2O)逆
-
甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.0 kJ• mol-1
CH3OH(g) △H1=-90.0 kJ• mol-1
②2CH3OH(g) CH3OCH3(g)+ H2O(g) △H2
CH3OCH3(g)+ H2O(g) △H2
回答下列问题:
(1)若由合成气(CO、H2)制备lmolCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ,则△H2=________kJ • mol-1。(已知:H2O(1)=H2O(g) △H=+44.0 kJ/mol)
(2)有人模拟该制备原理,500K时,在2L的密闭容器中充入2molCO和6mol H2,5min达到平衡,平衡时CO的转化率为60%,c(CH3OCH3)=0.2mol·L-1,用H2表示反应①的速率是_______mol·L-1·min-1,可逆反应②的平衡常数K2=_________。
若在500K时,测得容器中n(CH3OCH3)=2n(CH3OH),此时反应②的v正_______v逆(填“>”、“< ”或“=”)。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数K2值变小,下列说法正确的是_______。
A.在平衡移动过程中逆反应速率先增大后减小
B.容器中CH3OCH3的体积分数增大
C.容器中混合气体的平均相对分子质量减小
D.达到新平衡后体系的压强增大
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入CO(g)和H2(g)进行反应①,平衡时CO(g)和H2(g)的转化率如图所示,则a =_________(填数值)。
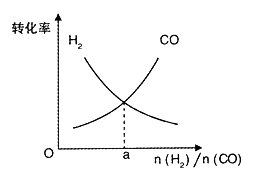
(5)绿色电源“二甲醚燃料电池”的结构图所示,电解质为熔融态的碳酸盐(如熔融 K2CO3),其中CO2会参与电极反应。工作时负极的电极反应为____________。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做__________。

-
二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g) CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g) CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
(2)反应①达平衡后采取下列措施,能提高CH3OH产率的有__________。
A.加入H2 B.升高温度 C.增大压强 D.使用催化剂
(3)在一定温度下,将4mol CO和4mol H2混合置于2L的密闭容器中发生反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g),60s时达到平衡状态时,测得气体的总物质的量为4mol。达平衡时,氢气的转化率为__________,用CO表示的反应速率为__________,该反应的平衡常数为__________。
CH3OCH3(g)+CO2(g),60s时达到平衡状态时,测得气体的总物质的量为4mol。达平衡时,氢气的转化率为__________,用CO表示的反应速率为__________,该反应的平衡常数为__________。
(4)以下说法能说明反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)达到平衡状态的有__________。
CH3OCH3(g)+CO2(g)达到平衡状态的有__________。
A. 氢气和二氧化碳的浓度之比为3∶1
B.单位时间内断裂3个H-H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(5)二甲醚燃料电池的工作原理如图所示:
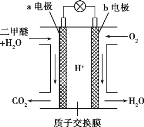
该电池负极的电极反应式为__________。
-
二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g) CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g) CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有 。
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是 。
(4)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 。
A.△H <0
B.P1<P2<P3
C.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%[
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为 。
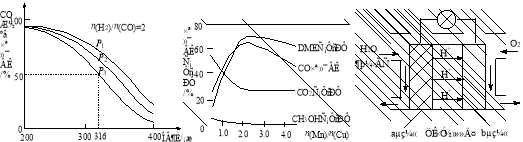
图1 图2 图3
(7)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,
CH3 HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 。
-
二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) △H1=- 90.7 kJ·mol-1
CH3OH(g) △H1=- 90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H=_____________ kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=_____________ kJ·mol-1。
(2)在不同温度下按照相同物质的量投料发生反应①,测得CO的平衡转化率与压强的关系如图所示,下列说法正确的是_____________。
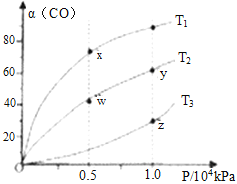
A.反应温度: T1>T2 B.正反应速率:υ正(y)=υ正(w)
C.混合气体密度: ρ(x)>ρ(w) D.混合气体平均摩尔质量:M(y)<M(z)
E.该反应的△S<0、△H<0,所以能在较低温度下自发进行
(3)采用一种新型的催化剂(主要成分是Cu-Mn 的合金),利用CO和H2制备二甲醚(DME)。如图回答问题; 催化剂中 约为_____________时最有利于二甲醚的合成。
约为_____________时最有利于二甲醚的合成。

(4)高温时二甲醚发生分解反应: CH3OCH3 CH4+CO+H2。迅速将二甲醚引入一个504℃的抽成真空的瓶中,在不同时刻t测定瓶内压强P总如下表。
CH4+CO+H2。迅速将二甲醚引入一个504℃的抽成真空的瓶中,在不同时刻t测定瓶内压强P总如下表。
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| P总/kPa | 50.0 | 78.0 | 92.0 | 99.0 | 100 | 100 |
①该反应的平衡常数表达式为Kp=_____________。
②该反应的平衡常数Kp=_____________。(带单位。某一物质的平衡分压=总压×物质的量分数)
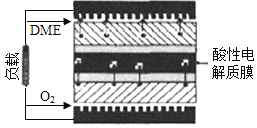
(5)一种以二甲醚作为燃料的燃料电池的工作原理如图所示。则其负极的电极反应式为_______________。该电池的理论输出电压为1.20V,则其能量密度E=_____________(列式计算。能量密度=电池输出电能/燃料质量,1kW·h=3.6×106J,法拉第常数F=96500C·mol-1)。
CH3OH(g) △H1=- 90.7 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
CH3OCH3(g)+CO2(g)的△H=_____________ kJ·mol-1。

约为_____________时最有利于二甲醚的合成。

CH4+CO+H2。迅速将二甲醚引入一个504℃的抽成真空的瓶中,在不同时刻t测定瓶内压强P总如下表。

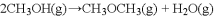
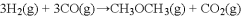 的
的


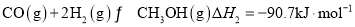 ;
;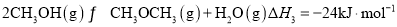 。
。








