-
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3P轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体。根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为 (用元素符号表示)。
(2)化合物BD3的分子空间构型是 。
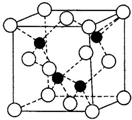
(3)上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED),其材料是E与F形成的化合物甲(属于第三代半导体),用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。化合物甲的晶胞结构如右图(白球代表F,黑球代表E)。试回答:
①该晶胞中所包含的F原子(白色球)个数为 。
②与同一个E原子相连的F原子构成的空间构型为 。
③下列说法正确的是 。
A.该晶胞结构与NaCl相同 B.半导体EB与EF互为等电子体
C.电负性:F>E D.EF晶体中含有配位键
④ (CH3)3E中E原子的杂化方式为 。
⑤该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为 (写出计算过程)
-
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3P轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体。根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为________(用元素符号表示)。
(2)化合物BD3的分子空间构型是________。
(3)上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED),其材料是E与F形成的化合物甲(属于第三代半导体),用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。化合物甲的晶胞结构如右图(白球代表F,黑球代表E)。试回答:
①该晶胞中所包含的F原子(白色球)个数为________。
②与同一个E原子相连的F原子构成的空间构型为 ________。
③下列说法正确的是________。
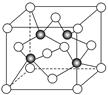
A.该晶胞结构与NaCl相同 B.半导体EB与EF互为等电子体
C.电负性:F>E D.EF晶体中含有配位键
④ (CH3)3E中E原子的杂化方式为________。
⑤该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为________
(写出计算过程)
-
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增。B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题:
(1)B、C、D的第一电离能由小到大的顺序为_______________________(用元素符号表示);
(2)写出比D的原子序数大7的Q原子的电子排布式_______________;
(3)化合物BD3的空间构型是_______________;
(4)上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED),其材料是E与F形成的化合物甲(属于第三代半导体),用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。化合物甲的晶胞结构如图(白球代表F,黑球代表E)。试回答:
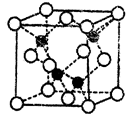
①该晶胞中所包含的F原子个数为___________;
②与同一个E原子相连的F原子构成的空间构型为___________;
③下列说法正确的是___________;
a.E、F处于同一周期
b.该晶胞结构与NaCl相同
c.电负性:F>E
d.EF晶体中含有配位键
④(CH3)3E中E原子的杂化方式为___________;
-
【化学——选修3物质结构与性质】已知R、W、X、Y、Z是周期表中前四周期元素,它们的原子序数依次递增. R的基态原子中占据哑铃形原子轨道的电子数为1; W的氢化物的沸点比同族其它元素氢化物的沸点高;X2 +与W2-具有相同的电子层结构;Y元素原子的3P能级处于半充满状态;Z+的电子层都充满电子。请回答下列问题:
(1)写出Z的基态原子的外围电子排布式_____。
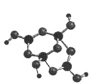
( 2)R的某种钠盐晶体,其阴离子Am- (含R、W、氢三种元素)的球棍模型如上图所示: 在Am- 中,R原子轨道杂化类型有_____ ;m=_____。(填数字)
(3)经X射线探明,X与W形成化合物的晶体结构与NaCl的晶体结构相似,X2+的配位原 子 所构成的立体几何构型为_____。
(4)往Z的硫酸盐溶液中加入过量氨水,可生成[Z(NH3)4]S04,下列说法正确的是_____
A. [Z(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B. 在[Z(NH3)4 ]2+中Z2+给出孤对电子,NH3提供空轨道
C. [Z(NH3)4]SO4的组成元素中第一电离能最大的是氧元素
D. SO42-与PO43-互为等电子体,空间构型均为四面体
(5)固体YCl5的结构实际上是YCl4+和YCl6- 构成的离子晶体,其晶体结构与CsCl相似。若晶胞边长为a pm,则晶胞的密度为_____g•cm-3.
-
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是________,B、C、D的电负性由小到大的顺序为______(用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是____________________。
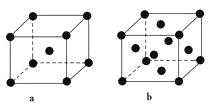
(2)E原子的基态电子排布式为________。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:________。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________。
(5)温室效应,科学家设计反应:CO2+4H2—→CH4+2H2O以减小空气中CO2。若有1 mol CH4生成,则有________mol σ键和________mol π键断裂。
-
前四周期六种元素 Q、R、X、Y、Z、W 的原子序数依次递增。已知:①Z 的 d 轨道和 s 轨道都是半充满,W 的 d 轨道和 s 轨道都是全满,其余元素均为短周期主族元素;Y 原子的价电子(外围电子)排布为 msnmpn;②R 原子核外 L 层电子数为奇数;③Q、X 原子 p 轨道的电子数分别为 2 和 4。请回答下列问题:
(1)第一电离能:I1(R)_______________I1(X)(填“>”或“<”或“=”),原因是__________________________
(2)在[W(NH3)4]2+离子中,配体是_____________,1 mol 该配离子中含有 σ 键的物质的量为_______________mol。
(3) Q 与 Y 形成的最简单气态氢化物分别为甲、乙,下列判断正确的是_______________。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q 的一种氢化物相对分子质量为 26,下列叙述正确的是_______________
a.中心原子是 sp1 杂化 b.该分子既含极性键又含非极性键
c.该分子只含σ键 d.该分子极易溶于水
(5)元素 Z 属于_______________区元素,电子排布式是_______________。
-
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z元素的正三价离子的3d轨道为半充满,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn ;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z元素基态原子的外围电子排布式为___________________。
(2)五种元素中,电负性最大与最小的两种非金属元素形成的物质的化学式为。(3)Q、R、X 三种元素的第一电离能数值由小到大的顺序为。(用元素符号作答)
(4)Z元素的正三价离子的硝酸盐水溶液显________性,试用离子方程式解释其原因:________。
(5)Q的一种氢化物组成18电子的分子,其化学式(分子式)为。
-
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满。B、E两元素组成化合物B2E的晶体为离子晶体。C、F的原子均有三个能层,C原子的第一至第四电离能(KJ·mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1∶3、熔点为190 ℃的化合物Q。
(1)B的单质晶体为体心立方堆积模型,其配位数为____________;E元素的最高价氧化物分子的立体构型是________________。F元素原子的核外电子排布式是_______________,G的高价离子与A的简单氢化物形成的配离子的化学式为________________。
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由________________。
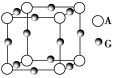
(3)A、G形成某种化合物的晶胞结构如图所示。若阿伏加德罗常数为NA,该化合物晶体的密度为a g·cm-3,其晶胞的边长为________ cm。
(4)在1.01×105 Pa、T1 ℃时,气体摩尔体积为53.4 L·mol-1,实验测得Q的气态密度为5.00 g·L-1,则此时Q的组成为________________。
-
(12分)已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满。B、E两元素组成化合物B2E的晶体为离子晶体。C、F的原子均有三个能层,C原子的第一至第四电离能(KJ·mol-1)分别为578、1817、2745、11575;C与F能形成原子数目比为1∶3、熔点为190 ℃的化合物Q。
(1)B的单质晶体为体心立方堆积模型,其配位数为____________;E元素的最高价氧化物分子的立体构型是________________。F元素原子的核外电子排布式是_______________,G的高价离子与A的简单氢化物形成的配离子的化学式为________________。
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由________________。
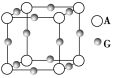
(3)A、G形成某种化合物的晶胞结构如图所示。若阿伏加德罗常数为NA,该化合物晶体的密度为a g·cm-3,其晶胞的边长为________ cm。
(4)在1.01×105 Pa、T1 ℃时,气体摩尔体积为53.4 L·mol-1,实验测得Q的气态密度为5.00 g·L-1,则此时Q的组成为________________。
-
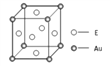
A、B、C、D、E是原子序数依次增大的前四周期的常见元素。己知:
| A | 原子半径最小 |
| B | 核外3个能级上的电子数相等 |
| C | 其氢化物的沸点比同族相邻周期元素氢化物的沸点高 |
| D | 2p轨道上成对电子数与未成对电子数相等 |
| E | N 层电子数为1,内层轨道全部排满电子 |
(1)写出E原子基态核外电子排布式_____________。比较B、C、D电负性的大小顺序______ (按由小到大) 。
(2)与C2互为等电子体的分子有_______,离子有_________。
(3)E2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图),画出其中E2+离子与N、O原子间的化学键。________。

(4)E和金(Au)形成的合金的晶胞结构如图,则该合金的化学式可表示为________________。