-
A、B、C、D、E、F、G、I均为前四周期原子序数依次增大的元素。A原子的L电子层的p能级上有一个空轨道;C的最外层有6个运动状态不同电子;D的基态原子外围电子排布式为3S2;E与D同周期,且在该周期中电负性最大;F、G是同族且原子序数差2的元素;I的基态原子外围只有一个单电子。
(1) 下列关于A2H4分子和H2C2分子的说法正确的是 。
A.分子中都含有σ键和π键
B.中心原子都sp2杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体
E.A2H4分子的沸点明显低于H2C2分子
(2)A、B、C三种元素中的两种,能形成原子个数比为l:3的常见微粒,推测这两种微粒的空间构型为 。
(3)E能形成多种含氧酸,如HEO3、HEO2,请简述酸性HEO3大于HEO2的原因: 。
(4) G与AC能形成挥发性液体G(AC)4,则其固体属于 晶体。
(5) F常见晶体结构为体心立方堆积,原子半径为a nm,I常见晶体结构为面心立方堆积,原子半径为b nm,则两种金属的密度比为 (用含a、b的算式表示)。
高二化学推断题困难题查看答案及解析
-
A、B、C、D、E、F、G、I均为前四周期原子序数依次增大的元素。A原子的L电子层的p能级上有一个空轨道;C的最外层有6个运动状态不同电子;D的基态原子外围电子排布式为3S2;E与D同周期,且在该周期中电负性最大;F、G是同族且原子序数差2的元素;I的基态原子外围只有一个单电子。
(1) 下列关于A2H4分子和H2C2分子的说法正确的是 。
A.分子中都含有σ键和π键 B.中心原子都sp2杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体 E.A2H4分子的沸点明显低于H2C2分子
(2)A、B、C三种元素中的两种,能形成原子个数比为l:3的常见微粒,推测这两种微粒的空间构型为 。
(3)E能形成多种含氧酸,如HEO3、HEO2,请简述酸性HEO3大于HEO2的原因: 。
(4) G与AC能形成挥发性液体G(AC)4,则其固体属于 晶体。
(5) F常见晶体结构为体心立方堆积,原子半径为a nm,I常见晶体结构为面心立方堆积,原子半径为b nm,则两种金属的密度比为 (用含a、b的算式表示)。
(6) 已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为________________,由Cl-所形成的化学键类型是________。
高二化学填空题中等难度题查看答案及解析
-
(16分) 已知A、B、C、D、E、F六种元素,它们的原子序数依次增大。A、E是同一主族的短周期元素,A原子最外层S能级和P能级轨道上的电子数相等,C+与B2-具有相同的电子层结构,D原子的最外层电子数等于其电子层数,且A、B、C、D、E五种元素的原子序数之和是F元素原子序数的2倍。请回答下列问题:
(1)元素E基态原子的电子排布式_____________.
(2)B、C、D三种元素形成简单离子的半径由大到小的顺序是 (用离子符号表示)
(3)F元素在元素周期表中的位置______________________.
(4)B、E两种元素形成的晶体类型为______________________.
(5)电负性:A B,
氢化物的稳定性:B E,
第一电离能:C D,
最高价氧化物对应水化物的碱性:C D(填“>”或“<”)。
高二化学填空题困难题查看答案及解析
-
元素A、B、C、D、E、F、G的原子序数依次增大,A、F原子的最外层电子数等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同的能级,且每个能级上排布的电子数相等;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F;G原子最外层有一个单电子,且内层原子轨道均排满。
(1)与C单质分子互为等电子体的分子为_____,该分子的电子式为______________。
(2)B、C、D三种元素第一电离能从大到小的顺序:________(填元素符号)
(3)光谱证实:单质F与强碱性溶液反应有[F(OH)4]-生成,则[F(OH)4]-中存在_________。
a、共价键 b、非极性键 c、配位键 d、σ键 e、π键
(4)B、C、D三种元素与A形成的最简单化合物的稳定性由强到弱的顺序:____(填化学式)
(5)G位于元素周期表的____区,向含有G2+离子的溶液中通入A、C形成的最简单分子至过量所涉及的两个离子方程式_________________________________________________。
高二化学综合题中等难度题查看答案及解析
-
元素A、B、C、D、E、F、G的原子序数依次增大,A、F原子的最外层电子数等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同的能级,且每个能级上排布的电子数相等;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F;G原子最外层有一个单电子,且内层原子轨道均排满。
(1)与C单质分子互为等电子体的分子为________,该分子的电子式为______________。
(2)B、C、D、E、F五种元素第一电离能从大到小的顺序:____________(填元素符号)
(3)光谱证实:单质F与强碱性溶液反应有[F(OH)4]-生成,则[F(OH)4]-中存在_________。
a、共价键 b、非极性键 c、配位键 d、σ键 e、π键
(4)B、C、D三种元素与A形成的最简单化合物的稳定性由强到弱的顺序:______(填化学式)
(5)G位于元素周期表的____区,向含有G2+离子的溶液中通入A、C形成的最简单分子至过量,观察到的现象是_________________________________________________。
高二化学推断题极难题查看答案及解析
-
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);基态D原子的价电子排布式为______________________。
(2)A的最高价氧化物分子中,其中心原子采取________杂化;BC3-的立体构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)化合物CH3COO[Cu(NH3)3·CO]中与Cu+形成配离子的配体为____________(填化学式)。
(5) CH3COOH中C原子杂化轨道类型为_________________。
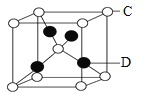
(6)元素D与元素C形成一种化合物其晶胞结构如图所示,该化合物的化学式为______.
高二化学综合题中等难度题查看答案及解析
-
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);基态D原子的电子排布式为_____。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC
的立体构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________,电子式为__________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比________。
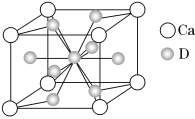
(5)镍元素的原子价电子排布式为_____________________.
镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________________(填数值);氢在合金中的密度为_____________。(写出表达式即可)
高二化学综合题中等难度题查看答案及解析
-
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的内部各能层均排满,且最外层有一个电子;D与E同周期,价电子数为2。则:
(1)写出基态E原子的价电子排布式___________。
(2)A的单质分子中π键的个数为________。
(3)A、B、C三种元素第一电离能由大到小的顺序为_______(用元素符号表示)
(4)B元素的氢化物的沸点是同族元素中最高的,原因是_______。
(5)A的最简单氢化物分子的空间构型为_____,其中A原子的杂化类型是__。
(6)C和D形成的化合物的晶胞结构如图,已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,求晶胞边长a=__________ pm. (用ρ、NA,C和D化合物的摩尔质量为M g.mol-1的计算式表示)

高二化学综合题中等难度题查看答案及解析
-
X、Y、Z、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次外层电子数少2,M原子外围电子排布式为3dn4sn;W的内层电子已全充满,最外层只有2个电子。
请回答下列问题:
(1)X元素在周期表中的位置是____;W2+离子的外围电子排布式为___。
(2)X 能与氢、氮、氧三种元素构成化合物 XO(NH2)2,其中X原子和N原子的杂化方式为分别为___、___,该化合物分子中的π键与σ键的个数之比是____;该物质易溶于水的主要原因是___。
(3)已知Be和Al元素处于周期表中对角线位置,化学性质相似,请写出Y元素与Be元素两者相应的最高价氧化物对应水化物相互反应的化学方程式:____。
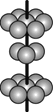
(4)M晶体的原子堆积方式为六方堆积(如图所示),则晶体中M原子的配位数是___。某M配合物的化学式是[M(H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是____。
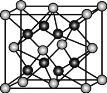
(5)Y离子和Z离子比较,半径较大的是___(填离子符号),元素Y与元素Z形成的晶体的晶胞结构是如图所示的正方体,每个Y离子周围与它最近的Y离子有___个。
高二化学填空题中等难度题查看答案及解析
-
(17分)X、Y、Z、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次外层电子数少2,M原子外围电子排布式为3dn4sn;W的内层电子已全充满,最外层只有2个电子。请回答:
(1)X元素在周期表中的位置是 ;
W2+离子的外围电子排布式为 。
(2)X 能与氢、氮、氧三种元素构成化合物 XO(NH2)2,其中X原子和N原子的杂化方式为分别为 、 ,该化合物分子中的
键与
键的个数之比是 ;该物质易溶于水的主要原因是 。
(3)已知Be和Al元素处于周期表中对角线位置,化学性质相似,请写出Y元素与Be的最高价氧化物的水化物相互反应的化学方程式
(4)M晶体的原子堆积方式为六方堆积(如图所示),则晶体中M原子配位数是 。某M配合物化学式是[M(H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是 。
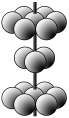
(5)X 的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为 。
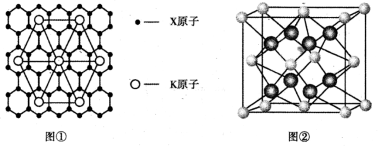
(6)Y离子和Z离子比较,半径较大的是___(写离子符号),元素Y与元素Z形成的晶体的晶胞结构是如图②所示的正方体,设晶胞中最近的两个Z离子的距离为a cm ,该化合物的摩尔质量为bg/ mol ,则该晶胞密度的计算式为 。(只要求列算式,不必计算出数值,阿伏伽德罗常数用NA表示)。
高二化学简答题极难题查看答案及解析