-
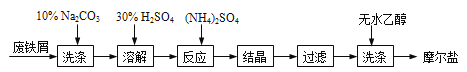
绿矾( FeSO4·7H2O )、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为: (NH4)2 SO4 + FeSO4 + 6H2O =(NH4)2SO4·FeSO4·6H2O↓。其流程可表示为:
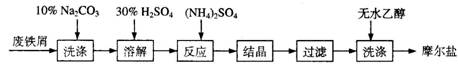
(1)洗涤中Na2CO3的主要作用是________。
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到________时,停止加热。
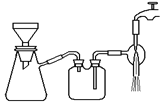
(3)过滤是用下图所示装置进行的,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是________。
(4)用无水乙醇洗涤的目的是________。
(5)产品中Fe2+的定量分析:制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性条件下KMnO4标准液滴定的方法。称取4.0g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液10.00mL。
①本实验的指示剂是________。(填字母)
A. 酚酞 B.甲基橙C.石蕊D.不需要
②产品中Fe2+的质量分数为________。
-
(每空2分,共10分)绿矾(FeSO4·7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为:
(NH4)2SO4+FeSO4+6H2O===(NH4)2SO4·FeSO4·6H2O↓。其流程可表示为:
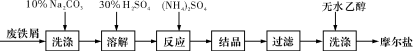
(1)洗涤中Na2CO3的主要作用是_____________。
(2)结晶过程中需要加热蒸发溶剂,加热到_____________(填字母)时,停止加热,冷却结晶。
A.沸腾 B.液体表面出现晶膜
C.析出少量晶体 D.快蒸干,还有少量液体
(3)过滤是用下图装置进行,这种过滤跟普通过滤相比,过滤速度较快的原因是___。
(4)用无水乙醇洗涤的目的是①___________,②__________。
-
绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为:
(NH4)2SO4+FeSO4+6H2O=(NH4)2SO4•FeSO4•6H2O↓。其流程可表示为:
(1)洗涤中Na2CO3的主要作用是 。
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到 时,停止加热。
(3)过滤是用下图装置进行,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是 。
(4)用无水乙醇洗涤的目的是 。
(5)产品中Fe2+的定量制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性条件下KMnO4标准液滴定的方法。称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol·L-1KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①本实验的指示剂是 。
②产品中Fe2+的质量分数为 。
-
绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为:
(NH4)2SO4+FeSO4+6H2O=(NH4)2SO4•FeSO4•6H2O↓。其流程可表示为:

(1)洗涤中Na2CO3的主要作用是 。
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到 时,停止加热。
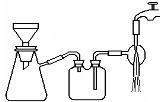
(3)过滤是用下图装置进行,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是 。
(4)用无水乙醇洗涤的目的是 。
(5)产品中Fe2+的定量分析:制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性条件下KMnO4标准液滴定的方法。称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol·L-1 KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①本实验的指示剂是 。
A.酚酞 B.甲基橙 C.石蕊 D.不需要
②产品中Fe2+的质量分数为 。
-
已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定.以下是将绿矾、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图.根据下图回答:
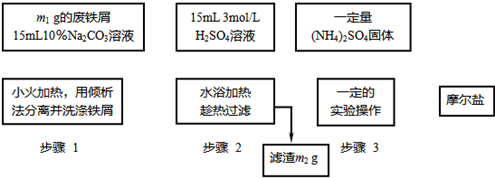
(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因:______.
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有______:
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2中铁屑过量的目的是(用离子方程式表示):______.步骤2中溶液趁热过滤的原因是______.
(4)步骤3中,加入(NH4)2SO4固体后,应加热到______时,停止加热.需经过的实验操作包括:______、______、减压过滤(或抽滤)等得到较为______的晶体.
(5)抽滤装置的仪器有:______、______、安全瓶、抽气泵组成.
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+.为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性下用KMnO4标准液滴定的方法.
称取4.0g的摩尔盐样品,溶于水,并加入适量稀硫酸.用0.2mo1/L KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00mL.
①请完成滴定过程中发生的离子方程式:
______Fe2++______MnO4-+______=______Mn2++______Fe3++______H2O
②本实验的指示剂______.
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于______(酸式、碱式)滴定管中
④终点颜色的变化:______.
⑤产品中Fe2+的质量分数为______.
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为:______.(用a,b,c回答)
-
实验室以工业废铁为原料制取绿矾(FeSO4·7H2O),并用绿矾为原料制备Fe(OH)SO4溶液和NH4Fe(SO4)2·12H2O晶体,其实验流程如下:
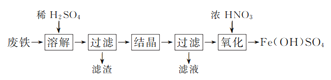
已知:FeSO4·7H2O和NH4Fe(SO4)2·12H2O随温度变化的溶解度曲线如下图。
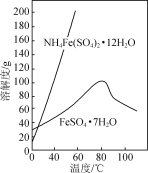
(1)废铁溶解前需要用热的饱和Na2CO3溶液浸泡,目的是________。
(2)溶解时控制溶液温度为70~80 ℃,目的是__________________,溶解时铁需过量的原因是________________。
(3)氧化时将绿矾分批次加入到浓硝酸中,搅拌,反应1 h,有红棕色气体生成,同时得到Fe(OH)SO4,发生的化学方程式为________________。氧化结束后不能采用加热煮沸的方法除去溶液中剩余的硝酸,理由是________________(任写一条)。
(4)设计以绿矾和硫酸铵为原料,制取纯净NH4Fe(SO4)2·12H2O的实验方案:________________(已知pH=1时出现Fe(OH)3沉淀。实验中可以选用的试剂:1.0 mol·L-1稀硫酸、2.0 mol·L-1稀盐酸、5%H2O2溶液)。
-
实验室以工业废铁为原料制取绿矾(FeSO4·7H2O),并用绿矾为原料制备Fe(OH)SO4溶液和NH4Fe(SO4)2·12H2O晶体,其实验流程如下:
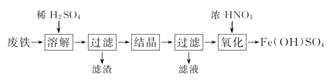
已知:FeSO4·7H2O和NH4Fe(SO4)2·12H2O随温度变化的溶解度曲线如下图。
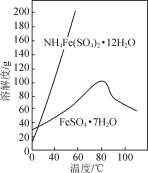
(1)废铁溶解前需要用热的饱和Na2CO3溶液浸泡,目的是________。
(2)溶解时控制溶液温度为70~80 ℃,目的是__________________,溶解时铁需过量的原因是________________。
(3)氧化时将绿矾分批次加入到浓硝酸中,搅拌,反应1 h,有红棕色气体生成,同时得到Fe(OH)SO4,发生的化学方程式为________________。氧化结束后不能采用加热煮沸的方法除去溶液中剩余的硝酸,理由是________________(任写一条)。
(4)设计以绿矾和硫酸铵为原料,制取纯净NH4Fe(SO4)2·12H2O的实验方案:________________(已知pH=1时出现Fe(OH)3沉淀。实验中可以选用的试剂:1.0 mol·L-1稀硫酸、2.0 mol·L-1稀盐酸、5%H2O2溶液)。
-
FeSO4 溶液放置在空气中容易变质,因此为了方便使用 Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。(稳定是指物质放置 在空气中不易发生各种化学反应而变质)
I.硫酸亚铁铵晶体的制备与检验
(1)某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都必须煮沸、冷却后再使用,这样处理蒸馏水的目的是_______。向 FeSO4 溶液中加入饱和(NH4)2SO4 溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一 种浅蓝绿色的晶体。
(2)该小组同学继续设计实验证明所制得晶体的成分。
①如图所示实验的目的是_______,C 装置的作用是_______。
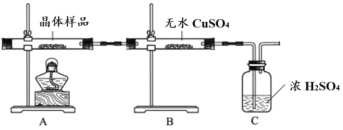
取少量晶体溶于水,得淡绿色待测液。
②取少量待测液,_______ (填操作与现象),证明所制得的晶体中有 Fe2+。
③取少量待测液,经其它实验证明晶体中有NH4+和SO42-
II.实验探究影响溶液中 Fe2+稳定性的因素
(3)配制 0.8 mol/L 的 FeSO4 溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2 溶液(pH=4.0),各取 2 ml 上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加 2 滴 0.01mol/L 的 KSCN 溶液,15 分钟后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液;FeSO4溶液则出现淡黄色浑浊。
(资料 1)
| 沉淀 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.6 | 2.7 |
| 完全沉淀pH | 9.6 | 3.7 |
①请用离子方程式解释 FeSO4 溶液产生淡黄色浑浊的原因_______。
②讨论影响 Fe2+稳定性的因素,小组同学提出以下 3 种假设:
假设 1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2 溶液中 Fe2+稳定性较好。
假设 2:其它条件相同时,在一定 pH 范围内,溶液 pH 越小 Fe2+稳定性越好。
假设 3:_______。
(4)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分 别控制溶液 A(0.2 mol/L NaCl)和溶液 B(0.1mol/L FeSO4)为不同的 pH,
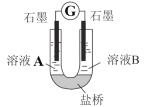
观察记录电流计读数,对假设 2 进行实验研究,实验结果如表所示。
| 序号 | A:0.2mol·L-1NaCl | B:0.1mol·L-1FeSO4 | 电流计读数 |
| 实验1 | pH=1 | pH=5 | 8.4 |
| 实验2 | pH=1 | pH=1 | 6.5 |
| 实验3 | pH=6 | pH=5 | 7.8 |
| 实验4 | pH=6 | pH=1 | 5.5 |
(资料 2)原电池装置中,其它条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原 电池的电流越大。
(资料 3)常温下,0.1mol/L pH=1 的 FeSO4 溶液比 pH=5 的 FeSO4 溶液稳定性更好。 根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U 型管中左池的电极反应式____________。
②对比实验 1 和 2(或 3 和 4) ,在一定 pH 范围内,可得出的结论为____________。
③对比实验____________和____________,还可得出在一定pH 范围内溶液酸碱性变化对 O2 氧化性强弱的影响因素。
④ 对(资料 3)实验事实的解释为____________。
-
FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
(资料1)
| 沉淀 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀 pH | 7.6 | 2.7 |
| 完全沉淀 pH | 9.6 | 3.7 |
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___________________。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:__________________________________________________。
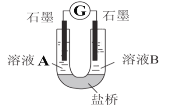
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
| 序号 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 电流计读数 |
| 实验1 | pH=1 | pH=5 | 8.4 |
| 实验2 | pH=1 | pH=1 | 6.5 |
| 实验3 | pH=6 | pH=5 | 7.8 |
| 实验4 | pH=6 | pH=1 | 5.5 |
(资料2)原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
(资料3)常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式_________________。
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为______ 。
③对比实验_____和_____ 还可得出在一定 pH范围内,溶液酸碱性变化是对O2氧化性强弱的影响因素。
④对(资料3)实验事实的解释为____________________。
-
FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
(资料1)
| 沉淀 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀 pH | 7.6 | 2.7 |
| 完全沉淀 pH | 9.6 | 3.7 |
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___________________。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:__________________________________________________。
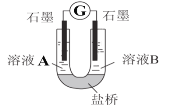
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
| 序号 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 电流计读数 |
| 实验1 | pH=1 | pH=5 | 8.4 |
| 实验2 | pH=1 | pH=1 | 6.5 |
| 实验3 | pH=6 | pH=5 | 7.8 |
| 实验4 | pH=6 | pH=1 | 5.5 |
(资料2)原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
(资料3)常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式_________________。
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为______ 。
③对比实验_____和_____ 还可得出在一定 pH范围内,溶液酸碱性变化是对O2氧化性强弱的影响因素。
④对(资料3)实验事实的解释为____________________。
















