-
实验室用硫酸铵、硫酸和废铁屑制备硫酸亚铁铵晶体的方法如下:
步骤1:将废铁屑依次用热的碳酸钠溶液、蒸馏水洗涤。
步骤2:向盛有洁净铁屑的烧杯中加入稀H2SO4溶液,水浴加热,使铁屑与稀硫酸反应至基本不再冒出气泡为止。趋热过滤。
步骤3:向滤液中加入一定量(NH4)2SO4固体。
硫酸亚铁晶体、硫酸铵、硫酸亚铁铵晶体的溶解度(g/100 g H2O)
温度物理溶解度
0 ℃
10 ℃
20 ℃
30 ℃
40 ℃
50 ℃
60 ℃
FeSO4·7H2O
15.6
20.5
26.5
32.9
40.2
48.6
-
(NH4)2SO4
70.6
73.0
75.4
78.0
81.0
-
88.0
(NH4)2SO4·FeSO4·6H2O
12.5
17.2
21.0
28.1
33.0
40.0
44.6
(1)步骤2中控制生成的硫酸亚铁中不含硫酸铁的方法是______________。
(2)在0~60 ℃内,从硫酸亚铁和硫酸铵的混合溶液中可获得硫酸亚铁铵晶体的原因是_______________________________________________________。
(3)为了从步骤3所得溶液中获得硫酸亚铁铵晶体,操作是___________________________。
(4)测定硫酸亚铁铵晶体中Fe2+含量的步骤如下:
步骤1:准确称取a g(约为0.5 g)硫酸亚铁铵晶体样品,并配制成100 mL溶液。
步骤2:准确移取25.00 mL硫酸亚铁铵溶液于250 mL锥形瓶中。
步骤3:立即用浓度约为0.1 mol·L-1 KMnO4溶液滴定至溶液呈稳定的粉红色,即为滴定终点。
步骤4:将实验步骤1~3重复2次。
①步骤1中配制100 mL溶液需要的玻璃仪器是___________________________________;
②为获得样品中Fe2+的含量,还需补充的实验是_________________________________。
高三化学实验题困难题查看答案及解析
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol·L-1H2SO4溶液,在 60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有__________(填仪器编号)
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研体 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中所加的硫酸必须过量,其原因是_______;
(3)在步骤3中,“一系列操作”依次为______、_______和过滤;
(4)本实验制得的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+常用的试剂是______,可以观察到的现象是________。
高三化学实验题简单题查看答案及解析
-
硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.
步骤2 向处理过的铁屑中加入过量的3mol•L-1H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液.
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体.
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有______(填仪器编号)
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中所加的硫酸必须过量,其原因是______;
(3)在步骤3中,“一系列操作”依次为______、______和过滤;
(4)本实验制的硫酸亚铁铵晶体常含有Fe3+杂质.检验Fe3+常用的试剂是______,可以观察到得现象是______.高三化学解答题中等难度题查看答案及解析
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3 mol·L-1H2SO4溶液,在60 ℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有________(填仪器编号);
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中所加的硫酸必须过量,其原因是
________________________________________________________________________;
(3)在步骤3中,“一系列操作”依次为________、________和过滤;
(4)本实验制得的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+常用的试剂是________________________________________________________________________,可以观察到的现象是
________________________________________________________________________。
高三化学实验题中等难度题查看答案及解析
-
(10分)实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%~30%的稀硫酸溶液,在50℃~80℃水浴中加热至不再产生气泡.将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口、静置、冷却一段时间后有浅绿色晶体析出,收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式: ;
(2)采用水浴加热的原因是 ;
(3)反应时铁屑过量的目的是(用离子方程式表示) ;
(4)溶液趁热过滤的原因是 ;
(5)塞紧试管口的目的是 。
高三化学实验题中等难度题查看答案及解析
-
硫代硫酸钠是一种重要的化工产品。某兴趣小组制备硫代硫酸钠晶体
的实验装置如下图所示(省略夹持装置):
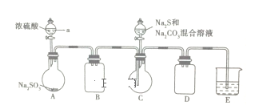
主要实验步骤为:①检查装置气密性,按图示加入试剂;②先向C中烧瓶加入
和
混合溶液,再向A中烧瓶滴加浓硫酸;③待
和
完全消耗后,结束反应。过滤C中混合物,滤液经一系列实验操作后得到产品。
已知:i
是无色透明晶体,易溶于水,其稀溶液与
溶液混合无沉淀生成;ii向
和
混合溶液中通入
可制得
所得产品常含有少量
和
。
回答下列问题:
(1)仪器a的名称是____________;B、D装置的作用是_____________。
(2)上述实验步骤③中的操作主要有_______________、冷却结晶、过滤、洗涤、干燥;E中的试剂是_____________。
(3)为检验产品中是否含有
和
,该小组设计了以下实验方案(所需试剂从稀硝酸、稀硫酸、稀盐酸、蒸馏水中选择),请将方案补充完整:
取适量产品配成稀溶液,滴加足量
溶液,有白色深沉生成,向沉淀中滴加足量的_________,若____________(填实验现象),则可以确定产品中含有
和
。
(4)为减少装置C中生成
的量,在不改变原有装置的基础上对实验步骤②需进行改进,具体操作是_________________;写出制备
的总反应的化学方程式:___________________________。
高三化学实验题中等难度题查看答案及解析
-
硫酸亚铁铵[ (NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:
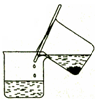
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用下所示方法分离出固体并洗涤、干燥。
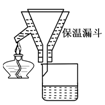
步骤2:FeSO4溶液的制备。将处理好的铁屑放入锥形瓶,加入过量的3 mol·L-1H2SO4溶液,加热至充分反应为止。趁热过滤(如图所示),收集滤液和洗涤液。
步骤3:硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过加热浓缩、冷却结晶、过滤、乙醇洗涤后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)步骤1中图13分离方法称为________法。
(2)步骤2中有一处明显不合理的是________。趁热过滤的理由是________。
(3)步骤3加热浓缩过程中,当________时停止加热。用无水乙醇洗涤晶体的原因是________。
(4)FeSO4·7H2O在潮湿的空气中易被氧化成Fe(OH)SO4·3H2O,写出该反应的化学方程式________。
高三化学实验题简单题查看答案及解析
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:
图1
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用图1所示方法分离出固体并洗涤、干燥。
步骤2:FeSO4溶液的制备。将处理好的铁屑放入锥形瓶,加入过量的3 mol·
L-1H2SO4溶液,加热至充分反应为止。趁热过滤(如图2所示),收集滤液和洗涤液。
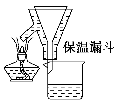
图2
步骤3:硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过加热浓缩、冷却结晶、过滤、乙醇洗涤后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)步骤1中图1分离方法称为________法。
(2)步骤2中有一处明显不合理的是___________________________________。
趁热过滤的理由是________________________________________________。
(3)步骤3加热浓缩过程中,当________时停止加热。用无水乙醇洗涤晶体的原因是______________________________________________________________。
(4)FeSO4·7H2O在潮湿的空气中易被氧化成Fe(OH)SO4·3H2O,写出该反应的化学方程式________________________________________________________。
高三化学实验题困难题查看答案及解析
-
实验室中采用废铁屑来制备硫酸铁铵[NH4Fe(SO4)2·xH2O]的具体流程如图:
(1)步骤①中通常加入热的碳酸钠溶液,其目的是__。
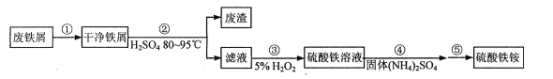
(2)步骤②需要加热的目的是___。铁屑中含少量硫化物,反应产生的气体可用图1所示装置进行净化处理,X溶液为___(填字母)。
A.蒸馏水 B.饱和食盐水 C.NaOH溶液 D.稀HNO3
(3)步骤③中,要保持溶液的pH<0.5的原因是___。
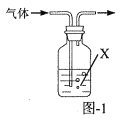
(4)步骤⑤包含抽滤操作(如图-2所示),仪器Y的名称为__。
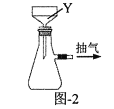
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为___。
高三化学工业流程困难题查看答案及解析
-
硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
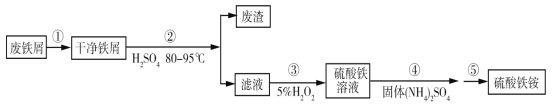
回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。
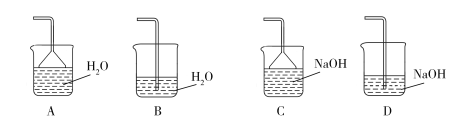
(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
高三化学综合题简单题查看答案及解析