-
某小组研究溶液中Fe2+与NO2-、NO3-的反应。
| 实验I | 试剂 | 现象 |
| 滴管 | 试管 |
| 
2mL | 1 mol·L-1 FeSO4溶液(pH=4) | 1 mol·L-1 NaNO2溶液(pH=8) | a.滴入1滴FeSO4溶液,溶液变黄色,继续滴加,溶液变为棕色。2小时后,无明显变化 |
| 1 mol·L-1 NaNO3溶液(加NaOH溶液至pH=8) | b.持续滴加FeSO4溶液,无明显变化。 |
资料:[Fe(NO)]2+在溶液中呈棕色。[Fe(NO)]2+ Fe2++NO。
Fe2++NO。
(1)研究现象a中的黄色溶液。
①用______溶液(填试剂名称)检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是________________________。
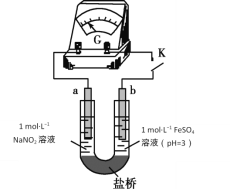
③进行实验Ⅱ,装置如图。证实了Fe2+被NO2-氧化为Fe3+。装置左侧烧杯中的试剂为:______________,实验过程中右侧电极上产生无色气泡,电极反应式为_____________________,左侧烧杯中的现象为:_____________________。
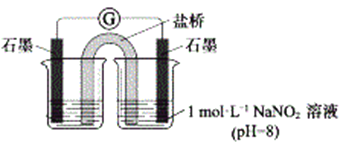
(2)研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是____________________________________________。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是________________________________________。
(3)研究酸性条件下,溶液中Fe2+与NO2-、NO3-的反应。
| 序号 | 操作 | 现象 |
| ⅰ | 取1 mol·L-1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 溶液立即变为棕色 |
| ⅱ | 取1 mol·L-1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 无明显变化 |
| ⅲ | 分别取0.5 mL 1 mol·L-1的NaNO3溶液与1 mol·L-1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
①ⅰ中溶液变为棕色的离子方程式是____________________________、Fe2++NO =[Fe(NO)]2+。
②ⅲ中出现棕色的原因是________________________________。
实验结论:本实验条件下,溶液中NO2−、NO3−的氧化性与溶液的酸碱性等有关。
-
某小组以亚硝酸钠(NaNO2)溶液为研究对象,探究NO2-的性质。
| 实验 | 试剂 | 编号及现象 |
| 滴管 | 试管 |
| 
2mL | 1%酚酞溶液 | 1 mol·L-1 NaNO2溶液 | 实验I:溶液变为浅红色,微热后红色加深 |
| 1 mol·L-1 NaNO2溶液 | 0.1 mol·L-1 KMnO4 溶液 | 实验II:开始无明显变化,向溶液中滴加稀硫酸后紫色褪去 |
| KSCN溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 实验III:无明显变化 |
| 1 mol·L-1 NaNO2溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 实验IV:溶液先变黄,后迅速变为棕色,滴加KSCN溶液变红 |
资料:[Fe(NO)]2+在溶液中呈棕色。
(1)结合化学用语解释实验I“微热后红色加深”的原因 ______
(2)实验II证明NO2-具有_____性, 从原子结构角度分析原因_________
(3)探究实验IV中的棕色溶液
①为确定棕色物质是NO与Fe2+,而非Fe3+发生络合反应的产物,设计如下实验,请补齐实验方案。
| 实验 | 溶液a | 编号及现象 |
| 
| 1 mol·L-1FeSO4溶液(pH=3) | i.溶液由___色迅速变为___色 |
| ____________________ | ii.无明显变化 |
②加热实验IV中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释上述现象产生的原因_________。
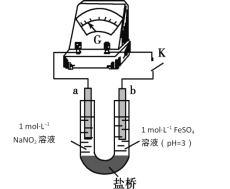
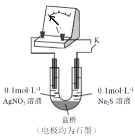
(4)络合反应导致反应物浓度下降,干扰实验IV中氧化还原反应发生及产物检验。小组同学设计实验V:将K闭合后电流表指针发生偏转,向左侧滴加醋酸后偏转幅度增大。
①盐桥的作用是____________________________
②电池总反应式为______________________
实验结论:NO2-在一定条件下体现氧化性或还原性,氧还性强弱与溶液酸碱性等因素有关。
-
某小组以亚硝酸钠(NaNO2)溶液为研究对象,探究NO2-的性质。
| 实验 | 试剂 | 编号及现象 |
| 滴管 | 试管 |
| 
2mL | 1%酚酞溶液 | 1 mol·L-1 NaNO2溶液 | 实验I:溶液变为浅红色,微热后红色加深 |
| 1 mol·L-1 NaNO2溶液 | 0.1 mol·L-1 KMnO4 溶液 | 实验II:开始无明显变化,向溶液中滴加稀硫酸后紫色褪去 |
| KSCN溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 实验III:无明显变化 |
| 1 mol·L-1 NaNO2溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 实验IV:溶液先变黄,后迅速变为棕色,滴加KSCN溶液变红 |
资料:[Fe(NO)]2+在溶液中呈棕色。
(1)结合化学用语解释实验I“微热后红色加深”的原因 ______
(2)实验II证明NO2-具有_____性, 从原子结构角度分析原因_________
(3)探究实验IV中的棕色溶液
①为确定棕色物质是NO与Fe2+,而非Fe3+发生络合反应的产物,设计如下实验,请补齐实验方案。
| 实验 | 溶液a | 编号及现象 |
| 
| 1 mol·L-1FeSO4溶液(pH=3) | i.溶液由___色迅速变为___色 |
| ____________________ | ii.无明显变化 |
②加热实验IV中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释上述现象产生的原因_________。
(4)络合反应导致反应物浓度下降,干扰实验IV中氧化还原反应发生及产物检验。小组同学设计实验V:将K闭合后电流表指针发生偏转,向左侧滴加醋酸后偏转幅度增大。
①盐桥的作用是____________________________
②电池总反应式为______________________
实验结论:NO2-在一定条件下体现氧化性或还原性,氧还性强弱与溶液酸碱性等因素有关。
-
某实验小组研究溶液中AgNO3和Na2S的反应。
| 实验 | 试剂 | 现象 |
| 
| 试管 | 滴管 |
| 0.1mol/LAgNO3溶液 (pH = 4) | 0.1mol/L Na2S溶液 (pH = 9) | 出现黑色沉淀 |
(1)用离子方程式解释Na2S溶液pH > 7的原因:________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为Ag+和SO42-;ii.Ag2O能溶解在浓氨水中形成银氨溶液,而Ag2S和Ag均不能。
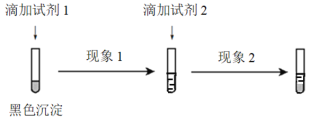
① 设计并实施如下实验,证实沉淀中含有Ag2S。
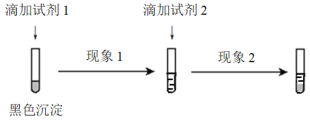
试剂1和试剂2分别是_________、_________。
现象1和现象2分别是_________、_________。
② 设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作和现象补充完整。
| 实验操作 | 实验现象 |
| 步骤i | 取少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
| 步骤ii | 取少量洗涤后的黑色沉淀,____________ | ____________ |
③ 经检验,沉淀不含有Ag。
(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如图所示),测得电压为a(a>0)。对AgNO3溶液中氧化S2-的物质进行推测:
假设1:0.1mol/L的AgNO3溶液中氧化了S2-;
假设2:0.1mol/L的AgNO3溶液中NO3-氧化了S2-。
利用下图装置继续研究(已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
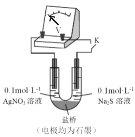
①将0.1mol/L的AgNO3溶液替换为_______溶液,记录电压为b( )。
)。
② 上述实验证实了氧化S2-的物质中一定包含Ag+,其证据是______。
实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。
-
某实验小组研究溶液中AgNO3和Na2S的反应。
| 实验 | 试剂 | 现象 |
| 
| 试管 | 滴管 |
| 0.1mol/LAgNO3溶液 (pH = 4) | 0.1mol/L Na2S溶液 (pH = 9) | 出现黑色沉淀 |
(1)用离子方程式解释Na2S溶液pH > 7的原因:________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为Ag+和SO42-;ii.Ag2O能溶解在浓氨水中形成银氨溶液,而Ag2S和Ag均不能。
① 设计并实施如下实验,证实沉淀中含有Ag2S。
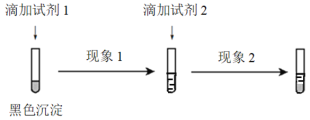
试剂1和试剂2分别是_________、_________。
现象1和现象2分别是_________、_________。
② 设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作和现象补充完整。
| 实验操作 | 实验现象 |
| 步骤i | 取少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
| 步骤ii | 取少量洗涤后的黑色沉淀,____________ | ____________ |
③ 经检验,沉淀不含有Ag。
(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如图所示),测得电压为a(a>0)。对AgNO3溶液中氧化S2-的物质进行推测:
假设1:0.1mol/L的AgNO3溶液中氧化了S2-;
假设2:0.1mol/L的AgNO3溶液中NO3-氧化了S2-。
利用下图装置继续研究(已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
①将0.1mol/L的AgNO3溶液替换为_______溶液,记录电压为b( )。
)。
② 上述实验证实了氧化S2-的物质中一定包含Ag+,其证据是______。
实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。
-
某实验小组研究溶液中AgNO3和Na2S的反应。
| 实验 | 试剂 | 现象 |
| 
| 试管 | 滴管 |
| 0.1mol/LAgNO3溶液 (pH = 4) | 0.1mol/L Na2S溶液 (pH = 9) | 出现黑色沉淀 |
(1)用离子方程式解释Na2S溶液pH > 7的原因:________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为Ag+和SO42-;ii.Ag2O能溶解在浓氨水中形成银氨溶液,而Ag2S和Ag均不能。
① 设计并实施如下实验,证实沉淀中含有Ag2S。
试剂1和试剂2分别是_________、_________。
现象1和现象2分别是_________、_________。
② 设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作和现象补充完整。
| 实验操作 | 实验现象 |
| 步骤i | 取少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
| 步骤ii | 取少量洗涤后的黑色沉淀,____________ | ____________ |
③ 经检验,沉淀不含有Ag。
(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如图所示),测得电压为a(a>0)。对AgNO3溶液中氧化S2-的物质进行推测:
假设1:0.1mol/L的AgNO3溶液中氧化了S2-;
假设2:0.1mol/L的AgNO3溶液中NO3-氧化了S2-。
利用下图装置继续研究(已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
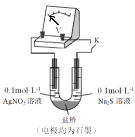
①将0.1mol/L的AgNO3溶液替换为_______溶液,记录电压为b( )。
)。
② 上述实验证实了氧化S2-的物质中一定包含Ag+,其证据是______。
实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。
-
某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。
| 实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
| 
| ① | 0.2 mol/L NaClO溶液 | 饱和Ag2SO4溶液 | 产生白色沉淀 |
| ② | CH3COOH溶液 | 光照管壁有无色气泡 |
| ③ | 0.2mol/LFeSO4酸性溶液和KSCN溶液 | 溶液变红 |
| ④ | 0.2mol/L的AlCl3溶液 | 产生白色沉淀 |
则以下判断不正确的是
A. 实验①:发生的反应为Ag++ClO-+H2O=AgCl↓+2OH- B. 实验②:无色气体为O2
C. 实验③:还原性强弱顺序Fe2+>Cl- D. 实验④:ClO-与Al3+的水解相互促进
-
某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应:
实验:向盛有2mL 0.1mol/L Ba(NO3)2 溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色。
探究1:白色沉淀产生的原因。
(1)白色沉淀是 。
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2。
① 支持甲同学观点的实验证据是 。
② 依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式 。
③ 乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
| 实验操作 | 实验现象 |
| 向2mL mol/L 溶液(填化学式)中通入SO2 | |
探究2:在氧化SO2的过程中,NO3-和O2哪种微粒起到了主要作用。
| 实验操作 | 实验数据 |
| 向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 | 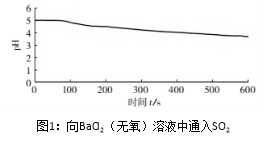
|
| 向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2 ,用pH传感器分别测定溶液pH随时间(t)变化的曲线。 | 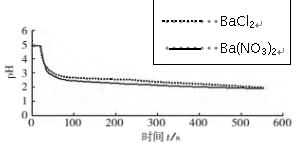 
|
(3)图1,在无氧条件下,BaCl2溶液pH下降的原因是_________。
(4)图2,BaCl2溶液中发生反应的离子方程式为__________。
(5)依据上述图像你得出的结论是 ,说明理由 。
-
碳酸亚铁(白色固体,难溶于水)是种重要的工业原料,可用于制备补血剂乳酸亚铁。某研究小组 通过下列实验,寻找利用复分解反应制各FeCO3的最佳方案:
| 实验 | 试剂 | 现象 |
| 滴管 | 试管 |
| 
| 0.8mol/LFeSO4溶液(pH=4.5) | 1mol/LNa2CO3溶液(pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,后出现明显的红褐色 |
| 0.8mol/LFeSO4溶液(pH=4.5) | 1mol/LNaHCO3溶液(pH=8.6) | 实验Ⅱ: 产生白色沉淀及少量无色气泡,2min,后出现明显的灰绿色 |
| 0.8mol/L(NH4)2Fe(SO4)2溶液(pH=4.0) | 1mol/LNaHCO3溶液(pH=8.6) | 实验Ⅲ: 产生白色沉淀及无色气泡,较长时间保持白色 |
(1)实验I中产生HCO3-和红褐色沉淀的离子方程式为___________
(2)实验Ⅱ中产生FeCO3的离子方程式为___________
(3)为了探究实验Ⅲ中NH4+所起的作用,甲同学设计了实验Ⅳ进行探究:
| 操作 | 现象 |
| 实验Ⅳ | 向0.8mol/LFeSO4溶液中加入_____,再加入一定量Na2SO4固体配制成混合溶液(已知Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与2mL1mol/LNaHCO3溶液混合 | 与实验Ⅲ现象相同 |
实验Ⅳ中加入Na2SO4固体的目的是_____
对比实验Ⅱ、Ⅲ、Ⅳ,甲同学得出结论:NH4+水解产生H+,降低溶液pH,减少了副产物Fe(OH)2的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是_____.再取该溶液一滴管2mL 1mol/L NaHCO3溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验Ⅲ中FeCO3的纯度最高。需要利用如图所示的装置进行定量测定。
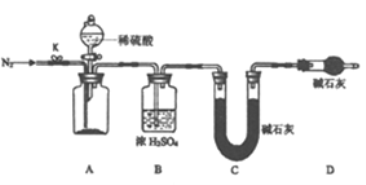
分别将实验Ⅰ、Ⅱ、Ⅲ中的沉淀进行过滤、洗涤、干燥后称量,然后转移至A处的广口瓶中。反应完成后通入N2的作用是_______。为测定FeCO3的纯度,除样品总质量外,还需测定的物理量是_________
(5)实验反思:经测定,实验Ⅲ中的FeCO3纯度高于实验Ⅰ和实验Ⅱ。通过以上实验分析。制备FeCO3实验成功的关键因素是__________.
-
某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验Ⅰ】试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)
| 操作 | 现象 |
| 取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________。
(2)产生气泡的原因是____________________。
【实验Ⅱ】 试剂:未酸化的0.5 mol·L-1FeSO4溶液(pH = 3),5% H2O2溶液(pH = 5)
| 操作 | 现象 |
| 取2 mL5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH=1.4 |
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是________。
(4)对于生成红褐色胶体的原因,提出两种假设:
i.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+ 氧化的产物发生了水解
① 根据实验II记录否定假设i,理由是________。
② 实验验证假设ii:取Fe2(SO4)3溶液加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是________。
【实验Ⅲ】
若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是________。
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与________(至少写两点)有关。
Fe2++NO。















