-
(10分)按照下列元素基态原子的电子排布特征判断元素,并回答问题:
A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后不能再容纳外来电子;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6
(1)以下分别是哪种元素(用元素符号填空):
A:_____________; C:_____________;D:____________;
(2)B原子的核外电子排布式。
(3)E的原子结构示意图________。
-
按照下列元素基态原子的电子排布特征判断元素,并回答问题:A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后不能再容纳外来电子;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)A~E分别是哪种元素(用元素符号填空):
A:__________;B:________;C:__________;D:________;E:________。
(2)E的原子结构示意图________________。
(3)C的轨道表示式____________________。
(4)B原子的核外电子排布式________________。
-
按照下列元素基态原子的电子排布特征判断元素,并回答问题:A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后没有未配对电子;C原子的2p轨道上没有空轨道上且电子的自旋方向相同;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)下列元素的名称是:B:________;E:________;
(2)D原子在元素周期表的___________区。
(3)C原子的电子排布图____________________。
(4)B原子的核外价电子排布式________________。
-
A、B、C、D、E、F为前四周期的元素.其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得.请回答下列问题:
(1)CB3分子中心原子的杂化类型是_________ ;
(2)如图所示为F与Au以3:1形成的合金晶胞图,在图中的括号内写出对应的元素符号.
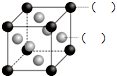
(3)B、D元素最高价氧化物对应的水化物的酸性强弱:_________(填化学式).
(4)用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式:_________;
(5)分子R是由C元素与氢元素形成的18电子分子,R的电子式为_________;
(6)24g E的单质在33.6L氧气(标准状况)中燃烧,至反应物全部耗尽,放出x kJ热量.则1mol E与O2反应生成E的低价氧化物时的热化学方程式为_________(已知:E的燃烧热为y kJ/mol)
-
短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个,则这三种元素所组成的化合物的分子式不可能是
A.X2YZ4 B.XYZ3 C.X3YZ4 D.X4Y2Z7
-
短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个,则这三种元素所组成的化合物的分子式不可能是 ( )
A.X2YZ4 B.XYZ3 C.X3YZ4 D.X4Y2Z7
-
短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个,则这三种元素所组成的化合物的分子式不可能是( )
A.X2YZ4 B.XYZ3 C.X3YZ4 D.X4Y2Z7
-
短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上的电子数少2个。则这三种元素所组成的化合物的分子式不可能是( )
A. X2YZ4 B. XYZ3 C. X3YZ4 D. X4Y2Z7
-
X、Y、Z三种短周期元素,X元素的原子最外层只有一个电子,Y元素的原子M电子层的电子数为K、L上电子总数的一半,Z元素的原子L层电子数比Y原子L层电子数少2个,由这三种元素组成的化合物的化学式可能是( )
A.X3YZ4
B.X2YZ3
C.XYZ2
D.X2YZ4
-
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比
B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为序40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子的数目之比为2∶1。请回答下列问题。
(1)A单质、B单质、化合物R的熔点大小顺为下列的________(填序号)。
①A单质>B单质>R ②R>A单质>B单质
③B单质>R>A单质 ④A单质>R>B单质
(2)CB3分子的空间构型是________,其固体时的晶体类型为______________。
(3)写出D原子的核外电子排布式:________________________,C的氢化物比D的氢化物在水中的溶解度大得多的原因是__________________________________________。
(4)B元素和D元素的电负性大小关系为____________。
(5)A与B形成的离子化合物的晶胞中,每个A+周围与它距离相等且最近的B-有______个,这些B-围成的空间几何构型为____________。
