-
(共10分)常温下,如果取0.1 mol
HA溶液与0.1mol
NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因:____(用离了方程式表示)。
(2)混合溶液中由水电离出的c(OH-)=____
(3)求出混合溶液中下列算式的精确计算结果(填具体数值):
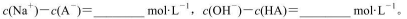
(4)己知NH4A 溶液为中性,又知HA溶液加到Na2CO3 溶液中有气体放出,试推断(NH3)2CO3 溶液的pH_____7(填“>”、“<”或“=”);
高二化学填空题中等难度题查看答案及解析
-
常温下,如果取0.1 mol/LHA溶液与0.1 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的PH=8,试回答以下问题:
⑴混合溶液的pH=8的原因(用离子方程式表示):______________________。
⑵混合溶液中由水电离出的c(H+)____0.1mol/L NaOH溶液中由水电离出的c(H+)。(填‘‘>”、“<”或“=”)
(3)求出混合液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)=____mol/L,c(H+)+c(HA)=__mol /L。
⑷已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的
pH___7(填“大于”、“小于”或“等于”);将同温度下等浓度的四种盐溶液:
A. NH4HCO3 B.NH4A C. (NH4)2SO4 D. NH4Cl
按pH由大到小的顺序排列是:____________(填序号)。
高二化学简答题中等难度题查看答案及解析
-
常温下,如果取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
①混合溶液的pH=8的原因(用离子方程式表示): 。
②求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)一c(A-)= mol/L,c(OH-)一c(HA)= mol/L。
③ 已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“大于”、“小于”或“等于”);
高二化学填空题困难题查看答案及解析
-
(1)常温下,如果取0.1mol•L-1HA溶液与0.1mol•L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol•L-1NaOH溶液中由水电离出的OH-浓度之比为_________;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH _____7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排 列顺序为_________(填序号)。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl.
(2)清洁能源具有广阔的开发和应用前景,可减小污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。
一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)⇌CH3OH(g)△H=-105kJ•mol-1.向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:

①Ⅱ和Ⅰ相比,改变的反应条件是_________;
②反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=_________;
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=_________;
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____T3(填“>”“<”“=”),判断的理由是_________;
(3)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e=2O2-)
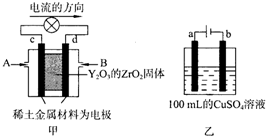
①c电极为_________正极,d电极上的电极反应式为_________;
②图乙是用惰性电极电解100mL 0.5mol•L-1 CuSO4溶液,a电极上的电极反应式为_________;若a电极产生56mL(标准状况)气体,则所得溶液的pH=_________(不考虑溶液体积变化),若要使电解质溶液 恢复到电解前的状态,可加入_________(选填字母序号)
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3.
高二化学填空题困难题查看答案及解析
-
常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混 合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因:__________________________________________________
(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)_______ 0.1mol/L NaOH溶液中由水电离出的c(H+)。
(填“>”“<”或“=”)
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)= ____________mol/L, c(OH-)-c(HA)= ______________mol/L.
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3 溶液的pH__________ 7(填“大于”“小于”或“等于”);将同温度下等浓度的四种盐溶液按pH由大到小的顺序排列是 ______________________(填字母序号)。
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
高二化学简答题困难题查看答案及解析
-
常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液中由水电离出的c(H+)_______0.1mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)
(2)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断:NH4HCO3溶液的pH_______7(填“大于”、“小于”或“等于”);
(3)将同温度下等浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列是:__________________________(填序号)
(4) 求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=_________mol/L,c(OH−)-c(HA)=_________mol/L
高二化学填空题困难题查看答案及解析
-
常温下,取0.1 mol·L-1HY溶液与0.1 mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法不正确的是
A.c(Na+)═c(Y-)+c(HY) B.c(OH-)═c9H+)+c(HY)
C.c(Y-)>c(Na+)>c(OH-)>c(H+) D.c(Na+)+c(H+)═c(OH-)+c(Y-)
高二化学选择题中等难度题查看答案及解析
-
(8分) 常温下,取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(忽略体积的变化),测得混合溶液的pH=9。试回答以下问题:
(1)液的pH=9的原因是_________________________(用离子方程式表示);
(2)混合后的溶液中由水电离出的c(OH-)为a,pH=9 的NaOH溶液中由水电离出的c(OH-)为b,则a________b(填“>”、“<”或“=”),a︰b=________。
(3)在混合溶液中c(HA) + c(A-) = ________ mol/L。
高二化学填空题简单题查看答案及解析
-
常温下,取0.1 mol·L-1 H2X溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法正确的是
A.c(Na+)=2c(X2-)
B.c(OH-)=c(H+)+2c(H2X)+ c(HX-)
C.c(X2-)>c(Na+)>c(OH-)>c(H+)
D.c(Na+)+c(H+)=c(OH-)+c(X2-) + c(HX-)
高二化学选择题困难题查看答案及解析
-
常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是
A. 溶液中由水电离产生的H+浓度为1×10-7mol/L
B. c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L
C. 溶液中CH3COOH的电离程度小于CH3COONa的水解程度
D. 溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
高二化学单选题中等难度题查看答案及解析