-
从能量的变化和反应的快慢等角度研究反应具有重要意义。
(1)已知反应2H2+O2 =2H2O为放热反应,下图能正确表示该反应中能量变化的是 。
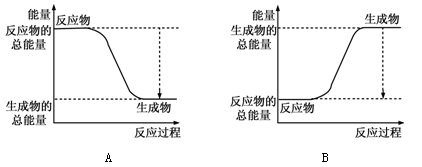
| 化学键 | H—H | O=O | H—O |
| 键能kJ/mol | 436 | 496 | 463 |
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如右表:则生成1mol水可以放出热量____________kJ
(2)原电池可将化学能转化为电能。将质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是 , 正极的反应式为 ,电解质溶液中SO42- 移向 极(填“正”或“负”)。一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。则导线中通过的电子的物质的量是 mol。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。
-
(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = 2H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。(填“A”或“B”)
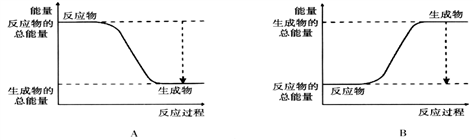
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
| 化学键 | H—H | O=O | H—O |
| 键能kJ/mol | 436 | 496 | 463 |
则生成1mol水可以放出热量 _____kJ
(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的有:
_________________(填序号),写出反应⑥的化学方程式________。
-
(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = 2H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。(填“A”或“B”)

从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
| 化学键 | H—H | O=O | H—O |
| 键能kJ/mol | 436 | 496 | 463 |
则生成1mol水可以放出热量 _____kJ
(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的有:
_________________(填序号),写出反应⑥的化学方程式________。
-
(12分)(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
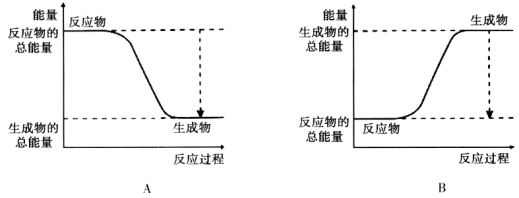
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
| 化学键 | H—H | O=O | H—O |
| 键能kJ/mol | 436 | 496 | 463 |
则生成1mol水可以放出热量 kJ
(2)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,负极是 (填“Cu”或“Fe”); 若Zn、Ag和稀盐酸构成原电池,正极发生 反应(填“氧化”或“还原”),电解质溶液中阳离子移向 极(填“正”或“负”)。质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。则导线中通过的电子的物质的量是 mol。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。
-
从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2=2NH3为放热反应:
①下图能正确表示该反应中能量变化的是____;

②根据下表数据,计算生成1 molNH3时该反应放出的热量为____kJ;
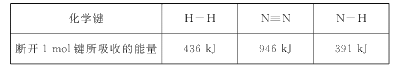
③一定温度下,将3 molH2和1 molN2通入容积为2L的密闭容器中发生反应,5 min达到平衡,测得c(NH3)=0.6 mol/L,则0至5 min时v(N2)=___,达到平衡时H2的转化率为____。
(2)某兴趣小组为研究原电池原理,设计如图装置。
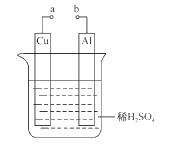
①a和b用导线连接,Cu极为原电池____极(填“正”或“负”),电极反应式是____;Al极发生____(填“氧化”或“还原”)反应,其电极反应式为____,溶液中SO42-移向____(填“Cu”或“Al”极)。溶液pH____(填增大或减小);当负极金属溶解5.4g时,____NA电子通过导线。
②不将a、b连接,请问如何加快Al与稀硫酸的反应速率?_______________
-
从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2 2NH3为放热反应;:
2NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________;
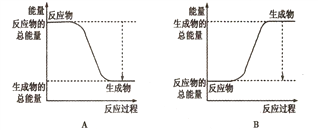
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
| 化学键 | H-H | N≡N | N-H |
| 断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2L的密闭容器中发生反应,5min达到平衡,测得c(NH3)=0.4mol/L,则O至5min时 (N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
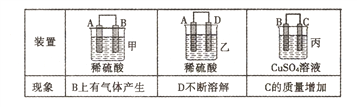
①装置甲甲SO42-向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是____;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后.取出洗净、干燥、称量.两电极质量差为6g。则导线中通过电子的物质的量为______mol。
-
从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2 2NH3为放热反应;:
2NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________;
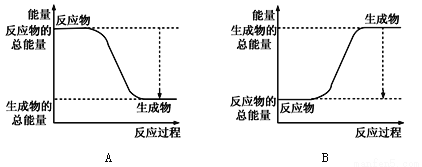
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
| 化学键 | H-H | N≡N | N-H |
| 断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2 L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=______,反应开始与平衡时气体的物质的量之比为__________;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 ,请用p0、p来表示达到平衡时H2的转化率为__________。
④ 在③反应条件下,能够判断该反应已经达到化学平衡状态的是______________。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成n mol N2 的同时生成2n mol NH3
D. v (N2)=2v(NH3)
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
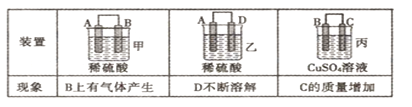
①装置甲中SO 向________ 极移动(填“A”或“B”);
向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是_____________;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为______mol。
-
从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2 2NH3为放热反应;:
2NH3为放热反应;:
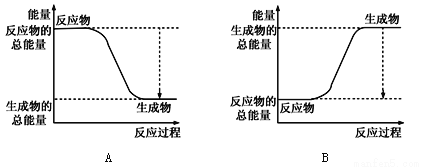
①下图能正确表示该反应中能量变化的是________;
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
| 化学键 | H-H | N≡N | N-H |
| 断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2 L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=______,反应开始与平衡时气体的物质的量之比为__________;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 ,请用p0、p来表示达到平衡时H2的转化率为__________。
④ 在③反应条件下,能够判断该反应已经达到化学平衡状态的是______________。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成n mol N2 的同时生成2n mol NH3
D. v (N2)=2v(NH3)
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
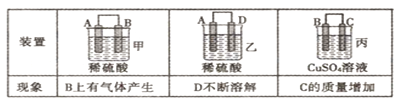
①装置甲中SO 向________ 极移动(填“A”或“B”);
向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是_____________;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为______mol。
-
从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)下图能正确表示该反应中能量变化的是________。

(3)从断键和成键的角度分析上述反应中能量的变化。
| 化学键 | H—H | O=O | H—O |
| 键能kJ/mol | 436 | 496 | 463 |
请填写下表:
| 化学键 | 填“吸收热量”或“放出热量” | 能量变化(kJ) |
| 拆开化学键 | 2molH2化学键 | ________ | ________ |
| 1molO2化学键 |
| 形成化学键 | 4molH-O键 | ________ | ________ |
| 总能量变化 | ________ | ________ |
(4)氢氧燃料电池的总反应方程式为2H2 +O2=2H2O。其中,氢气在______极发生_______反应。电路中每转移0.2mol电子,标准状况下消耗H2的体积是______L。
-
从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O
(1)为了加快该反应速率,不能采取的措施有________(填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度 C.扩大容器的体积 D.适当降低反应的温度
(2)该反应属于______反应(填“吸热”和“放热”)。
下图能正确表示该反应中能量变化的是________。
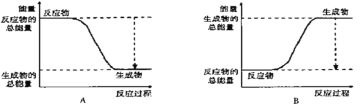
(3)氢氧燃料电池如图所示:
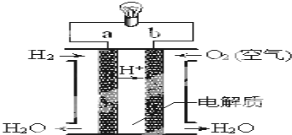
①a为________(填“正极”或“负极”),b电极发生_____反应(填“氧化”或“还原”);
②外电路中电子从b电极___,(填“流入”或“流出”),内电路中阳离子移向____极 (填”a”或”b”);
③写出该装置中正极上的电极反应式:___________________。

xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。














