-
(12分)已知2A2(g)+B2(g)  2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为
w mol/L,放出热量Q2 kJ。
(1)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度________(填>、=、<)w mol/L,Q1、Q2、Q3 之间满足何种关系________(用代数式表示)。
(2)能说明该反应已经达到平衡状态的是________。
 a.v(C3)=2 v (B2); b.容器内压强保持不变
a.v(C3)=2 v (B2); b.容器内压强保持不变
c.v逆(A2)=2 v正(B2) d.容器内的密度保持不变
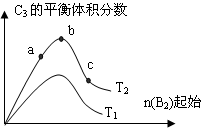
(3)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是________;
A.反应速率c>b>a
B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
D.b点时,平衡体系中A、B原子数之比接近2∶1
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2________Q4 ( 填 > 、 = 、 < ),理由是________。
-
已知2A2(g)+B2(g) 2C3(g) △H=-akJ·mol-1(a>0) ,在一个有催化剂、固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后
2C3(g) △H=-akJ·mol-1(a>0) ,在一个有催化剂、固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后 的浓度为xmol·L-1,放出热量bkJ。请回答下列问题:
的浓度为xmol·L-1,放出热量bkJ。请回答下列问题:
(1) a__________(填“>”、“=”或“ <”) b。
(2)下表为不同温度下反应的平衡常数。由此可推知,表中T1__________(填“ >”、“ < ”或“ =”) T2。
若在原来的容器中,只加入2molC3,500℃时充分反应达到平衡后,吸收热量ckJ,则C3的浓度__________(填“>”、“=” 或“ <”) xmol·L-1,a、b、c之间满足何种关系?__________(用代数式表示)。
(3)在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是__________(填字母)。
A.4molA2和2molB2 B.4molA2、2molB2和2molC3
C.4molA2和4molB2 D.6molA2和4molB2
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________(填字母)。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA2和1molB2,500℃时充分反应达到平衡后,放出热量dkJ,则d__________(填“>”、“=” 或“ <”) b,理由是__________。
(6)在一定温度下,在一个容积不变的容器中通入2molA2和1molB2及适量固体催化剂,使反应达到平衡。保持同一反应温度,在相同容器中,将起始物质改为4molA2和2molB2,则平衡时A2的转化率__________(填“不变”、“变大”、“变小”或“不能确定”)。
-
已知2A2(g)+B2(g) 2C(g);△H= -a kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:
2C(g);△H= -a kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:
(1)比较a______b(填>、=、<)
(2)此反应的平衡常数表达式为______________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)。
(3)若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量ckJ,a、b、c之间满足何种关系__________________(用代数式表示)。
(4)能说明该反应已经达到平衡状态的是________(填序号,有一个或多个选项符合题意,下同)。
a、v(C)=2v(B2) b、容器内气体压强保持不变
c、v逆(A2)=2v正(B2) d、容器内的气体密度保持不变
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
a、及时分离出C气体 b、适当升高温度
c、增大B2的浓度 d、选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2, 500℃时充分反应达平衡后,放出热量dkJ,则d_________b(填>、=、<)。
-
将1 mol A2和1 mol B2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2A2(g)+B2(g)  2A2B(g)。反应达到平衡时A2B为0.3 mol。若此时移走0.5 mol A2和0.5 mol B2,则重新达到平衡后,A2B的物质的量 ( )
2A2B(g)。反应达到平衡时A2B为0.3 mol。若此时移走0.5 mol A2和0.5 mol B2,则重新达到平衡后,A2B的物质的量 ( )
A.等于0.3 mol
B.等于0.15 mol
C.小于0.15 mol
D.大于0.15 mol,小于0.3 mol
-
如图所示的装置中发生反应2A2(g)+B2(g)⇌2C(g)△H=﹣a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向容积相同的A、B容器中分别都充入2mol A2和1mol B2气体.两容器分别在500℃达平衡时,A中C的浓度为c1mol/L,放出热量b kJ,B中C的浓度为c2mol/L,放出热量c kJ.下列说法中正确的是( )
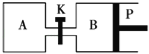
A.500℃达平衡时有:c1>c2
B.500℃达平衡时有:a>b>c
C.达平衡后打开K,容器B的体积将减小
D.此反应的平衡常数随温度升高而增大
-
如图所示的装置中发生反应2A2(g)+B2(g)⇌2C(g)△H=﹣a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向容积相同的A、B容器中分别都充入2mol A2和1mol B2气体.两容器分别在500℃达平衡时,A中C的浓度为c1 mol/L,放出热量b kJ,B中C的浓度为c2 mol/L,放出热量c kJ.下列说法中正确的是( )
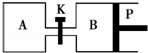
A.500℃达平衡时有:c1>c2
B.500℃达平衡时有:a>b>c
C.达平衡后打开K,容器B的体积将减小
D.此反应的平衡常数随温度升高而增大
-
已知 ,在一个有催化剂的固定容积的容器中加入2mol
,在一个有催化剂的固定容积的容器中加入2mol  和1mol
和1mol  ,在500℃时充分反应达平衡后
,在500℃时充分反应达平衡后 的浓度为w mol/L,放出热量b kJ。
的浓度为w mol/L,放出热量b kJ。
(1)比较a______b(填>、=、<)
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)

若在原来的容器中,只加入2mol  时充分反应达平衡后,吸收热量ckJ,
时充分反应达平衡后,吸收热量ckJ, 的浓度________(填>、=、<)w mol/L。
的浓度________(填>、=、<)w mol/L。
(3)在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4mol 和2mol
和2mol B.4mol
B.4mol 、2mol
、2mol 和2mol
和2mol 
C.4mol 和4mol
和4mol D.6mol
D.6mol 和4mol
和4mol
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是___________。
A.及时分离出 气体 B.适当升高温度
气体 B.适当升高温度
C.增大 的浓度 D.选择高效的催化剂
的浓度 D.选择高效的催化剂
-
(15分)已知2A(g)+B(g) 2C(g),H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
2C(g),H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
⑴比较a b(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1 T2(填“>”、“=”或“<”)。
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度 (填“>”“=”或“<”)ωmol/L,a、b、c之间满足何种关系 (用代数式表示)。
⑶ 在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是 。
A. 4 mol A和2 mol B B. 4 mol A、2 mol B和2 mol C
C. 4 mol A和4 mol B D. 6 mol A和4 mol B
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A. 及时分离出C气体 B. 适当升高温度
C. 增大B的浓度 D. 选择高效催化剂
⑸ 若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出热量为d kJ,则d b(填“>”、“=”或“<”),理由是_ 。
⑹ 在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,使之反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量 (填“不变”、“变大”、“变小”或“无法确定”)。
-
已知2A(g)+B(g)  2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
⑴比较ab(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1T2(填“>” “=”或“<”)。
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C 的浓度(填“>”、“=”或“<”)ωmol/L,a、b、c之间满足何种关系(用代数式表示)。
⑶在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是。
A.4molA和2molB B.4molA、2molB和2molC
C.4molA和4molB D.6molA和4molB
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是。
A.及时分离出C气体 B.适当升高温度
C.增大B的浓度 D.选择高效催化剂
⑸若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则db(填“>”“=”或“<”),理由是。
⑹在一定温度下,向一个容积可变的容器中,通入3molA和2molB及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量(填“不变”“变大”“变小”或“无法确定”)。
⑺某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小。已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出 AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系。下列说法错误的是________

A.A线是AgCl,C线是AgI
B.e点表示由过量的KI与AgNO3反应产生AgI沉淀
C.d点是在水中加入足量的AgBr形成的饱和溶液
D.B线一定是AgBr
-
(共16分)
Ⅰ.(10分)已知2A(g)+B(g)  2C(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。
2C(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。
(1)比较a b( 填 > 、 = 、 < )
(2)若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量ckJ,C物质的浓度 (填>、=、<)w mol/L,a、b、c之间满足的关系式为 (用含a、b、c的代数式表示)。
(3)能说明该反应已经达到平衡状态的是 。
a、V(C)=2V(B); b、容器内压强保持不变
c、V逆(A)=2V正(B) d、容器内的密度保持不变
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和lmolB,500℃时充分反应达平衡后,放出热量d kJ,则d b ( 填 > 、 = 、 < ),
Ⅱ.(6分)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),
NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
(1)电池放电时,负极的电极反应式为_______
(2)充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为________。
2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
 a.v(C3)=2 v (B2); b.容器内压强保持不变
a.v(C3)=2 v (B2); b.容器内压强保持不变


