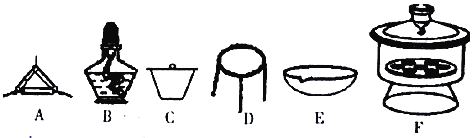-
(16分)为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题。(相对原子质量:C=12 O=16 Ca=40)
【方案Ⅰ】如图:
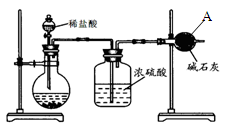
①称取碳酸钙样品m g;
②加入过量盐酸;
③测定仪器A的增重为a g。
(1)仪器A的名称是____________。
【方案Ⅱ】
①称取碳酸钙样品5.0 g;
②用1.00 mol/L盐酸100.0 mL(过量)溶解样品;
③取溶解后溶液体积的1/10 用0.1000mol/L NaOH溶液滴定,重复滴定三次,平均用去15.00mL。
(2)该碳酸钙样品的纯度= 。(计算结果保留三位有效数字)
【方案Ⅲ】
①称取碳酸钙样品mg;
②高温煅烧1000 ℃直至质量不再改变,冷却后称量,固体质量为m’g。
(3)本方案中的“冷却”应在干燥器中进行,理由是 。
【方案Ⅳ】
①称量碳酸钙样品m g;
②加入足量c mol/L盐酸V mL使之完全溶解;
③过滤并取滤液;
④在滤液中加入过量c ’mol/LNa2CO3溶液V’ mL;
⑤将步骤④中的沉淀滤出、洗涤、干燥、称重为b g。
(4)此方案中不需要的数据是(填字母序号) 。
A.m B.c、V C.c’、V’ D.b
(5)综上所述,你认为四个方案中,最好的方案是 。写出其它一个方案的缺点:(如:方案Ⅳ;沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差。)
方案 ; 。
-
(16分)为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案。请回答每个方案中提出的问题。
【方案I】
(1)称取碳酸钙样品 M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积 V mL。
问题1:反应结束后,量气管中的显示如右图所示,接下来的操作是:________,读出甲管中液面的读数。
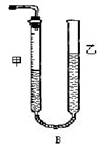
【方案II】
(1)称取碳酸钙样品 M g;
(2)用c mol/L 盐酸 V mL(过量)溶解样品;
(3)取溶解后的溶液 mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
问题2:列出本实验中所用到的主要仪器名称(除铁架台及附件、烧杯之外)________。
问题3:碳酸钙纯度计算公式________。
问题4:当碳酸钙溶解完全后,少量未溶的SiO2没过滤去,结果得到碳酸钙纯度________________(偏大、偏小或无影响)
【方案Ⅲ】
(1)称取碳酸钙样品 M g;
(2)加入足量c mol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量c′ mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题5:此方案中不需要的数据是________(填选项编号)。
A.c、V B.c′、 V′ C. M′ D. M
问题6:为减少实验误差,步骤(3)、(5)过滤后都要对沉淀进行洗涤,如果步骤(3)未经洗涤,则测定的碳酸钙的纯度将________(偏大、偏小、无影响,下同);如果步骤(5)未经洗涤,则测定的碳酸钙纯度将________。
问题7:判断步骤(4)中Na2CO3溶液是否过量的方法是________ 。
-
为测定碳酸钙粉末的纯度(含杂质SiO2),某学校学生设计了如下几个实验方案:
方案一:①称取碳酸钙样品M g;②加入过量盐酸;③收集并测定生成的气体体积V mL。
方案二:①称取碳酸钙样品M g;②用c mol/L盐酸V mL(过量)溶解样品;③取溶解后的溶液用c′mol/L NaOH溶液滴定,恰用去V′ mL。
方案三:①称取碳酸钙样品M g;②高温1000 ℃煅烧直至质量不再改变,冷却后称量,质量为M′ g。
方案四:①称取碳酸钙样品M g;②加入足量c mol/L盐酸V mL使之完全溶解;③过滤并取滤液;④在滤液中加入过量的c′mol/L Na2CO3溶液V′mL;⑤将步骤④中的沉淀滤出,洗涤、干燥、称量为M′g。
依据以上实验方案回答以下问题:
(1)方案一中如果称量样品时,砝码底部有一处未被发现的残缺,那么测得的碳酸钙纯度会________(填“偏高”、“偏低”或“无影响”)。
(2)方案二中:列出本实验中所用到的仪器名称(除铁架台、烧杯、铁架台附件外)_________________________________________________________________________。
(3)方案三中的“冷却”应如何操作:
____________________________________________________________;
理由是_________________________________________________________。
(4)方案四中计算碳酸钙纯度的公式为______________;步骤⑤中要将沉淀进行洗涤,如果未经洗涤,则测定结果碳酸钙纯度将________(填“偏高”、“偏低”或“无影响”)。
(5)综上所述,请从实验条件的难易、操作引起实验误差的大小等方面进行综合判断,你认为四个方案中,最好的方案是________。其他方案的缺点分别是:
方案四:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差。
方案________:_____________________________________________________。
方案________:____________________________________________________。
-
(9分)为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:
【方案I】
(1)组装发生并测定生成气体体积的实验装置,并检验气密性;
(2)称取碳酸钙样品W g;
(3)加入过量盐酸;
(4)收集并测定生成的气体体积V mL。
问题I—1:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸
钙的纯度会________(填“偏高、偏低、无影响”)。
问题I—2:在方框中画出测定生成的气体体积的装置简图。

【方案II】
(1)称取碳酸钙样品Wg;
(2)在锥形瓶中用C mol/L盐酸V mL(过量)溶解样品;
(3)加入甲基橙作指示剂,再用浓度为C1 mol/L的标准氢氧化钠溶液滴定过量的盐酸,用去氢氧化钠溶液V1毫升。(已知甲基橙的变色范围是pH=3.1~4.4)
问题II—1:未滤去不溶物SiO2,对测定结果是否有影响?(填有或无)________;
理由是________。
问题II—2:碳酸钙纯度表达式________。
【方案评价】
你认为以上两个方案中,最好的方案是,
另一个方案不够好的理由是________。
-
(12分)为测定碳酸钙的纯度(设含杂质SiO2),某兴趣小组的同学设计了如下几个实验方案:
方案Ⅰ
①称取碳酸钙样品M g
②用c1mol/L的盐酸V1 mL(过量)溶解样品
③取溶解后的溶液体积的十分之一,用c2 mol/L的NaOH溶液滴定,恰用去V2 mL。
方案Ⅱ
①称取碳酸钙样品M g
②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为M1 g
方案Ⅲ
①称取碳酸钙样品M g
②加入足量c mol/L的盐酸V mL使之完全溶解
③过滤并取滤液
④在滤液中加入过量c1 mol/L的Na2CO3溶液V1 mL
⑤将步骤④中的沉淀滤出、洗涤、干燥、称重,质量为M1 g。
根据以上实验方案,回答以下问题:
(1)方案Ⅰ中计算碳酸钙纯度的的公式为_________________________________。
(2)方案Ⅱ中的“冷却”应如何操作?________________;理由是_______________________。
(3)方案Ⅲ中不需要的数据是_____________(填选项编号)。
A.c、V B.c1、V1 C.M1 D.M
(4)方案Ⅲ中为了减少实验误差,必要的操作是_______________(填选项编号)。
A.精确测定Na2CO3溶液的体积V1 mL
B.精确配制Na2CO3溶液,使其浓度为c1 mol/L
C.将步骤③所得沉淀洗涤,洗涤液并入④中
(5)请再设计一个实验方案:________________________________。
-
为测定碳酸钠的质量分数(设含杂质碳酸氢钠),某学生设计了如下两个实验方案,请回答每个方案中的问题。
 [方案Ⅰ] 重量法:
[方案Ⅰ] 重量法:
(1)称量所需要的仪器是________。
(2)样品放在________仪器中灼烧。
a.蒸发皿 b.烧杯 c.坩埚
(3)实验中操作A的名称为________。
(4)如果灼烧后的样品放在空气中冷却,会造成实验结果________(填“偏大”、“偏小”或“不变”)。
(5)样品碳酸钠的质量分数________。已知该样品碳酸钠的质量分数为0.913,则本次实验的相对误差为________。
[方案II] 滴定法:①称取样品 M g;②用amol/L 过量盐酸VmL在烧杯中溶解样品,并加水稀释配成100mL溶液;③取溶解后的溶液20.00mL,用bmol/L NaOH溶液滴定,恰好用去V,mL;④重复③的操作2~3次。
(6)配成上述溶液所需要的容器的名称是________。滴定中还需要的试剂是________。
(7)操作④的目的是________。
(8)滴定测得的过量盐酸中含HCl的总物质的量的表达式为________。
(9)下列操作会使过量盐酸中含HCl测定值偏小的是________。
a.盛放氢氧化钠的滴定管只用蒸馏水洗涤
b.滴定过程中有液体溅出
c.滴定中用蒸馏水冲洗锥形瓶内壁
(10)综上所述,你认为2个方案中,较好的方案是________。
-
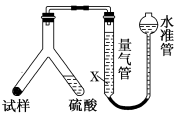
(10分)为测定某碳酸氢钠样品纯度(含有少量氯化钠),学生设计了如下几个实验方案(每个方案均称取m1g样品),请回答每个方案中的问题。
[方案Ⅰ] 选用重量法进行测定:可用下图中的装置进行实验。
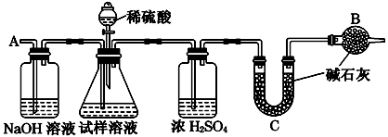
(1)A装置中NaOH溶液的作用是__________________若直接向试样溶液中鼓入空气会导致实验测定结果________(填“偏高”、“偏低”或“无影响”)。
(2)该方案需直接测定的物理量是______________________________________。
[方案Ⅱ] 选用气体体积法进行测定:可用如图中的装置进行实验,为了减小实验误差,量气管中加入饱和NaHCO3溶液。
(3)通过实验,测得该试样中碳酸氢钠质量分数偏低,产生这种现象
的原因可能是________。
a.测定气体体积时未冷却至室温
b.测定气体体积时水准管的液面高于量气管的液面
c.Y型管中留有反应生成的气体
d.气体进入量气管前未用浓硫酸干燥
[方案Ⅲ] 选用滴定法进行测定:
(4)称取m1g样品,配成100 mL溶液,取出20 mL,用c mol·L-1的标准HCl溶液滴定,消耗体积为VmL,则该试样中碳酸氢钠质量分数的计算表达式为:_________________。
-
(10分)为测定某碳酸氢钠样品纯度(含有少量氯化钠),学生设计了如下几个实验方案(每个方案均称取m1g样品),请回答每个方案中的问题。
[方案Ⅰ] 选用重量法进行测定:可用下图中的装置进行实验。
(1)A装置中NaOH溶液的作用是__________________若直接向试样溶液中鼓入空气会导致实验测定结果________(填“偏高”、“偏低”或“无影响”)。
(2)该方案需直接测定的物理量是______________________________________。
[方案Ⅱ] 选用气体体积法进行测定:可用如图中的装置进行实验,为了减小实验误差,量气管中加入饱和NaHCO3溶液。
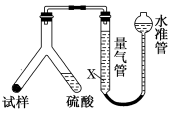
(3)通过实验,测得该试样中碳酸氢钠质量分数偏低,产生这种现象
的原因可能是________。
a.测定气体体积时未冷却至室温
b.测定气体体积时水准管的液面高于量气管的液面
c.Y型管中留有反应生成的气体
d.气体进入量气管前未用浓硫酸干燥
[方案Ⅲ] 选用滴定法进行测定:
(4)称取m1g样品,配成100 mL溶液,取出20 mL,用c mol·L-1的标准HCl溶液滴定,
消耗体积为VmL,则该试样中碳酸氢钠质量分数的计算表达式为:_________________
-
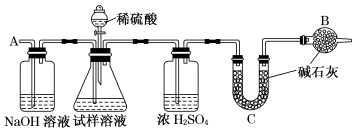
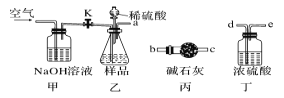
碱式碳酸镁可用于牙膏、医药化妆品等工业,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度。某兴趣小组设计了如下两个方案:
方案I:
取一定质量的样品,与硫酸充分反应,通过测定CO2的质量计算纯度
(1)乙中发生反应的方程式为______________________________ 。
(2)仪器接口的连接顺序为(装置可以重复使用) a__________,丁的作用是_________。
(3)关闭止水夹K,向样品中加入足量的稀硫酸,当样品充分反应完后,为了测定准确还应进行的操作是______________________________。
方案Ⅱ:
①称取碱式碳酸镁样品mg;②将样品充分高温灼烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g(用托盘天平称量)。
(4)下列仪器中,该方案不会用到的是____________。
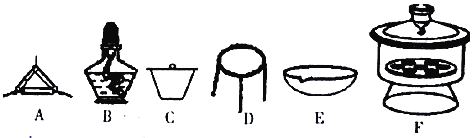
(5)有同学认为方案Ⅱ高温灼烧的过程中会发生MgCO3+SiO2 MgSiO3+CO2↑会导致测定结果有误,你认为这位同学的观点是否正确_____,(填“正确”或“错误”)请说明自己的理由:______________________。
MgSiO3+CO2↑会导致测定结果有误,你认为这位同学的观点是否正确_____,(填“正确”或“错误”)请说明自己的理由:______________________。
-
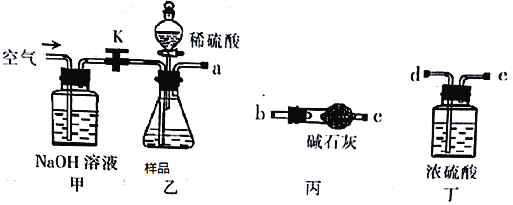
碱式碳酸镁可用于生产牙膏、医药和化妆品等,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁样品中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下几个
方案:
方案I 取一定质量的样品,与稀硫酸充分反应,通过测定生成CO2的质量计算纯度。
(1)乙中发生反应的化学方程式为___________________________。
(2)仪器接口的连接顺序为(装置可以重复使用)a→_____,丁的作用是____________。
(3)当样品充分反应后,缓慢通入空气的目的是____________________________。
方案II①称取碱式碳酸镁样品mg;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g。
(4)下列仪器中,该方案不会用到的是__________(填标号)。
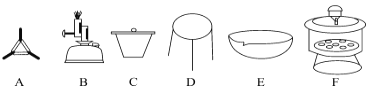
(5)判断样品完全分解的方法是________________。
(6)有同学认为方案II高温煅烧的过程中会发生MgCO3+SiO2 MgSiO3+CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______(填“正确”或“错误”)。请说明理由:________________________________。
MgSiO3+CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?______(填“正确”或“错误”)。请说明理由:________________________________。