-
合成氨工业的核心反应:N2(g)+3H2(g) 2NH3(g)的反应过程中能量变化如图所示,回答下列问题:
2NH3(g)的反应过程中能量变化如图所示,回答下列问题:

(1)ΔH=______;在反应体系中加入催化剂,反应速率增大,E2的变化是______(填“增大”“减小”或“不变”);△H (填“增大”“减小”或“不变”)。
(2)在500℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_______(填“<”“>”或“=”)46.2 kJ,理由__________________________________。
(3)已知在25℃、101 kPa时,14克CO气体完全燃烧放出热量为Q kJ。
请写出CO燃烧热的热化学方程式:______________________________________。
-
I.在500 ℃、2×107 Pa和催化剂条件下合成氨工业的核心反应是:N2(g)+3H2(g) 2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题:
2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题:
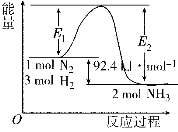
(1)在500 ℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_______(填“<”“>”或“=”)46.2 kJ,理由是_____________。
(2)将一定量的H2(g)和N2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。则该条件下达到平衡时H2的转化率为________。该温度下的平衡常数K的值为________(结果用分数表示)。若升高温度,K值________(填“增大”“减小”或“不变”)。
II.一定条件下,某容积为1L的密闭容器中发生如下反应:C(s) + H2O(g) CO(g) + H2(g)
CO(g) + H2(g)
(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均分子量为M,则M的范围为 。
(2)在(1)中若起始时充入的是2.5 molCO(g)和4molH2(g),达到平衡后混合气体的平均相对分子质量为 。
-
(4分)合成氨工业的核心反应是N2(g)+3H2(g) 2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题。
2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题。

(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化:E1________,E2________(填“增大”、“减小”或“不变”)。
(2)在500 ℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量________(填“<”、“>”或“=”)46.2 kJ,理由是____________________________________________________________。
-
合成氨工业的核心反应是N2(g)+3H2(g) 2NH3(g);反应过程中能量变化如图所示,回答下列问题。
2NH3(g);反应过程中能量变化如图所示,回答下列问题。
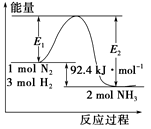
(1)该反应的ΔH=____________kJ/mol。
(2)在反应体系中加入催化剂,反应速率增大,E1的变化:E1__________(填“增大”、“减小”或“不变”)。
(3)在500℃、2×107Pa和催化剂条件下,向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量____________46.2 kJ (填“<”、“>”或“=”) 。
(4)关于该反应的下列说法中,正确的是________(填字母)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS>0 D.ΔH<0,ΔS<0
(5)已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(s,白磷)+5O2(g)===P4O10(s) ΔH 1=-2983.2 kJ·mol-1
P(s,红磷)+ O2(g)===
O2(g)===  P4O10(s) ΔH 2=-738.5 kJ·mol-1
P4O10(s) ΔH 2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
-
碳和氮的氢化物是广泛的化工原料,回答下列问题:
(1)工业上合成氨的反应为N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ/mol,反应过程中能量变化如图I所示。
2NH3(g) △H=-92.2kJ/mol,反应过程中能量变化如图I所示。

①氨分【解析】
2NH3(g) N2(g)+3H2(g)的活化能为_________kJ/mol
N2(g)+3H2(g)的活化能为_________kJ/mol
②合成氨时加入铁粉可以加快生成NH3的速率,在图I中画出加入铁粉后的能量变化曲线。_______
(2)联氨作火箭燃料的反应为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H1
已知:2O2(g)+N2(g)=N2O4(1) △H2 N2H4(1)+O2(g)=N2(g)+2H2O(g) △H3
上述热效应之间的关系式为△H1=____。某新型火箭用液氧/煤油代替联氨/N2O4,这种替换可能的好处是___(一条即可)。
(3)天然气制氢气是工业上制氢气的主要方法之一,其主要反应如下:
i.CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=-+206.4kJ/mol,
CO(g)+3H2(g) ΔH=-+206.4kJ/mol,
ii.CO(g)+ H2O(g) CO2(g)+H2(g) ΔH=-41.0kJ/mol
CO2(g)+H2(g) ΔH=-41.0kJ/mol
在一定温度下,2L的密闭容器中加入a molCH4和2amolH2O发生反应,t min时反应达平衡,测得容器内CObmol、CO2cmol。回答下列问题:
①下列可判断体系达到平衡状态的是_______。
A.CO的体积分数不变 B.容器内气体密度不变 C.3v(CH4)=v(H2) D. 不再变化
不再变化
②0~tmin反应速率v(CO2)=_____,CH4的的转化率为_____,反应ⅱ的平衡常数K=______。
③图Ⅱ中T℃之后c(CO2)随温度升高而减小的原因是_________。

-
合成氨工业的核心反应是:N2(g)+3H2(g) 2NH3(g)△H=QKJ/mol,能量变化如图所示,回答下列问题:
2NH3(g)△H=QKJ/mol,能量变化如图所示,回答下列问题:

(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1(填“增大”,、“减小”、“不变”,下同);E2-E1_______。
(2)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5 molN2和l.5 mol H2,充分反应后,放出的热量____46.2KJ。(填“<”、“>”或“=”)
(3)关于该反应的下列说法中,正确的是_____
A.△H>0,气体分子数目增多
B.△H>0,气体分子数目减少
C.△H<0,气体分子数目增多
D.△H<0 ,气体分子数目减少
(4)将一定量的N2(g)和H2(g)放入1L 密闭容器中,在500℃ 、2×l07 Pa下达到平衡,测得N2为0.10 mol, H2为0.30 mol, NH3为0.10 mol。计算该条件下达到平衡时H2的转化率_____。若升高温度,K值变化_______(填“增大”、“减小”或“不变)。
(5)在上述(4)反应条件的密闭容器中欲提移合成氨中H2的转化率,下列措施可行的_____(填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨气
-
(12分)合成氨工业的核心反应是:N2(g)+3H2(g)  2NH3(g) ΔH=Q kJ·mol-1,能量变化如图所示,回答下列问题:
2NH3(g) ΔH=Q kJ·mol-1,能量变化如图所示,回答下列问题:
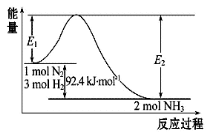
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是: E1_________(填“增大”、“减小”、“不变”)
(2)在500 ℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_______ 46.2 kJ(填“<”、“>”或“=”)
(3)关于该反应的下列说法中,正确的是_________。
A.ΔH>0,气体分子数目增多 B.ΔH>0,气体分子数目减少
C.ΔH<0,气体分子数目增多 D.ΔH<0,气体分子数目减少
(4)将一定量的N2(g)和H2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2转化为NH3的转化率_________。若升高温度,K值变化_______(填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中欲提高合成氨中H2的转化率,下列措施可行的__(填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨气
-
(12分)合成氨工业的核心反应是:N2(g)+3H2(g)  2NH3(g) ΔH=Q kJ·mol-1,能量变化如图所示,回答下列问题:
2NH3(g) ΔH=Q kJ·mol-1,能量变化如图所示,回答下列问题:

(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________(填“增大”、“减小”、“不变”)
(2)在500 ℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_________ 46.2 kJ(填“<”、“>”或“=”)
(3)关于该反应的下列说法中,正确的是_________。
A.ΔH>0,气体分子数目增多 B.ΔH>0,气体分子数目减少
C.ΔH<0,气体分子数目增多 D.ΔH<0,气体分子数目减少
(4)将一定量的N2(g)和H2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2转化为NH3的转化率_________。若升高温度,K值变化_______(填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中欲提高合成氨中H2的转化率,下列措施可行的__(填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨气
-
合成氨工业的核心反应是:N2(g)+3H2(g) 2NH3(g) Δ
2NH3(g) Δ H=QkJ·mol-1,能量变化如图所示,回答下列问题:
H=QkJ·mol-1,能量变化如图所示,回答下列问题:
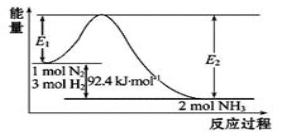
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________(填“增大”、“减小”、“不变”,下同);E2—E1 _________
(2)在500 ℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_________ 46.2 kJ(填“<”、“>”或“=”)
(3)关于该反应的下列说法中,正确的是_________
A.ΔH>0,气体分子数目增 多 B.ΔH>0,气体分子数目减少
多 B.ΔH>0,气体分子数目减少
C.ΔH<0,气体分子数目增多 D.ΔH<0,气体分子数目减少
(4)将一定量的N2(g)和H2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol ,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2的转化率_________。若升高温度,K值变化_______(填“增大”、“减小”或“不变”)。
,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2的转化率_________。若升高温度,K值变化_______(填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中欲提高合成氨中H2的转化率,下列措施可行的________填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨气
-
如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
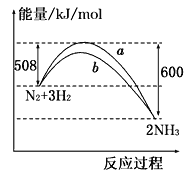
A. 该反应的热化学方程式为:N2 + 3H2  2NH3, △H = -92kJ·mol-1
2NH3, △H = -92kJ·mol-1
B. 在温度体积一定的条件下, 通入lmol N2和3molH2反应后放出的热量为92kJ
C. b曲线是加入催化剂时的能量变化曲线
D. 加入催化剂, 该化学反应的ΔH不改变
2NH3(g);反应过程中能量变化如图所示,回答下列问题。

O2(g)===
P4O10(s) ΔH 2=-738.5 kJ·mol-1









