-
(14分)某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图(夹持仪器略):

实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,
观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为________。
(2)在上述实验方案中有一明显欠缺,该欠缺是________。
(3)在欠缺已经得到改正的方案下,反应起始时,产生氢气的速率关系应是________;最终产生氢气体积的关系应是________。
(4)实验中产生的氢气体积比理论值高,可能原因是。
(5)通过比较起始反应的速率可以得出的结论是________。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中的一种方法________。
-
(18分)实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图:
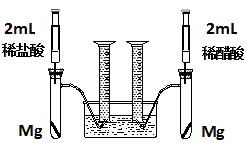
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为________。
(2)在上述实验方案中有一明显欠缺,该欠缺是________。
(3)在欠缺已经改正的方案下,反应起始时,产生氢气的速率关系应是________;最终产生氢气的体积关系应是________。
(4)实验中产生的氢气体积比理论值高,可能原因是________。
(5)通过比较起始反应的速率可以得出的结论是________。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中一种更简单的方法________
________。
实验二:某二元酸(H2B)在水中的电离方程式是: H2B=H++HB- HB- H++B2-
H++B2-
回答下列问题:
(1)请判断H2B是强电解质还是弱电解质?________
(2)已知0.1mol·L-1 NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度应________0.11 mol·L-1(填“<”,“>”或“=”)
(3)在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是_______。
A.c(H+)+c(HB-)+c(H2B)=0.1mol/L B.c(Na+)+c(OH-)=c(H+)+ c(HB-)
C.c(Na+)+ c(H+)= c(OH-)+ c(HB-)+2c(B2-) D.c(Na+)=2c(B2-)+2 c(HB-)
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是_______________________。
-
实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图:
 实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为________。
(2)在上述实验方案中有一明显欠缺,该欠缺是
。
(3)在欠缺已经改正的方案下,反应起始时,产生氢气的速率关系应是;最终产生氢气的体积关系应是 。
(4)实验中产生的氢气体积比理论值高,可能原因是。
(5)通过比较起始反应的速率可以得出的结论是。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中一种更简单的方法________
________。
实验二:某二元酸(H2B)在水中的电离方程式是: H2B=H++HB- HB- H++B2-
H++B2-
回答下列问题:
(1)请判断H2B是强电解质还是弱电解质?________
(2)已知0.1mol·L-1 NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度应________0.11 mol·L-1(填“<”,“>”或“=”)
(3)在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是_______。
A.c(H+)+c(HB-)+c(H2B)=0.1mol/L B.c(Na+)+c(OH-)=c(H+)+ c(HB-)
C.c(Na+)+ c(H+)= c(OH-)+ c(HB-)+2c(B2-) D.c(Na+)=2c(B2-)+2 c(HB-)
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是_______________________。
-
甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响。设计实验方案如下:
甲组:通过测定生成CO2气体体积的方法来比较化学反应速率的大小。
实验装置如图,实验时分液漏斗中A溶液一次性放入B溶液中
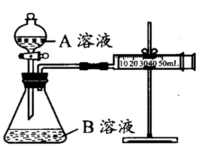
(注:实验中所用KMnO4溶液均已加人相同量H2SO4):
| 序号 | A溶液 | B溶液 |
| ① | 2 mL 0.1mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
| ② | 2 mL 0.2mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
(1)如何检查该装置的气密性:________。
(2)写出当锥形瓶中加入A溶液后发生的反应的离子方程式(提示:H2C2O4为弱酸):________。
(3)该实验探究的是________对化学反应速率的影响。分析所给实验仪器,实现该实验目的还欠缺的仪器:________。你将如何比较①②组化学反应速率大小?你的操作是________。
乙组:通过测定单位时间内KMnO4溶液浓度变化来判定反应速率快慢。
25℃时,40 mL 0.001mol/LKMnO4与38 mL0.1 mol/LH2C2O4和2 mL2.38mol/LH2SO4混合液共80 mL中KMnO4的浓度及对应时段的平均反应速率数据:
| 时间(min) | 4 | 8 | 12 | 16 | 21 | 22 | 23 | 24 | 25 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 | 0.16 | 0.13 |
| υ(KMnO4) (10-4mol/(L·min) | υ | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 | 0.07 | 0.03 |
(4)完成上表中υ=________×10-4mol/(L·min)。
问题讨论:已知该实验过程中溶液温度几乎不变,但是依据实验数据发现开始阶段速率却在增大。
①你认为引起该反应速率增大的因素是________。
②请设计实验证明你的观点,写出实验步骤及结论:
-
某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
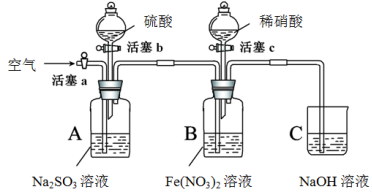
实验记录如下:
| 实验操作 | 实验现象 |
| I | 打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c | B中浅绿色溶液立即变为深棕色;一段时间后,溶液最终变为黄色。 |
| II | 用注射器取出少量B装置中的溶液,加入KSCN溶液 | 溶液变为红色。 |
| III | 打开活塞b,向A装置中加入足量硫酸,关闭活塞b | A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
| IV | 一段时间后,用注射器取出少量B装置中的溶液,…… | …… |
| V | 打开活塞a,通入一段时间空气 | ———— |
请回答下列问题:
(1)保存Fe(NO3)2溶液时,常加入铁粉,目的是(用化学方程式表示)________。
(2)实验I中,发生反应的离子方程式是________。
(3)资料表明,Fe2+能与NO结合形成深棕色物质[Fe(NO)]2+: Fe2+ + NO [Fe(NO)]2+
[Fe(NO)]2+
用平衡移动原理解释实验I中溶液由深棕色变为黄色的原因是________________________。
(4)分析实验现象,同学们得出了结论。则:
① 实验IV的后续操作是________________,观察到的现象是________________。
② 由实验得出的结论是_______________________。
(5)实验反思
① 实验操作V的目的是_______________________________________。
② 实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是________。
③ 有同学认为装置中的空气会干扰实验结论的得出,应在实验前通一段时间的氮气。你是否同意该看法,理由是________________________________________。
-
某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
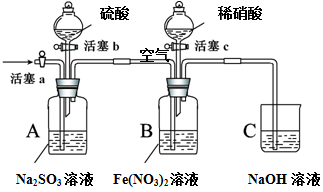
实验记录如下:
| 实验操作 | 实验现象 |
| I | 打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c | B中浅绿色溶液最终变为黄色。 |
| II | 用注射器取出少量B装置中的溶液,加入KSCN溶液 | 溶液变为红色。 |
| III | 打开活塞b,向A装置中加入足量硫酸,关闭活塞b | A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
| IV | 一段时间后,用注射器取出少量B装置中的溶液,…… | …… |
| V | 打开活塞a,通入一段时间空气 | ———— |
请回答下列问题:
(1)实验I中,发生反应的离子方程式是 。
(2)实验IV的后续操作是 ,观察到的现象是 。
(3)由实验得出的结论:酸性条件下氧化性由大到小的顺序是 。
(4) 实验操作V的目的是 。
(5)实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是 。
-
为清楚地看到无色NO遇空气变为红棕色(或浅棕色)的过程.某化学兴趣小组的甲、乙两位同学分别设计如下两个实验:
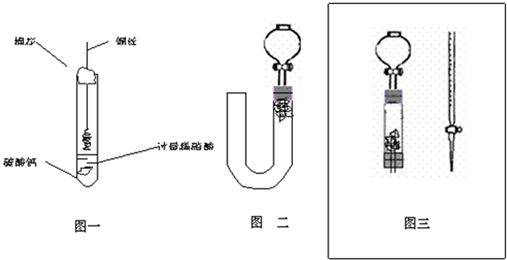
(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸②如图塞好疏松的棉花和铜丝③一段时间后,使铜丝浸入过量的硝酸反应④慢慢向试管底部推入棉花,可见明显现象.第①步放入大理石的作用是:______.
(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞,NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色.但按他的方法实际操作的丙同学发现此法至少存在两个问题:
①当酸液加到浸没分液漏斗下端管口以后,会______而使后面的实验无法观察到预期现象.
②反应开始后,因为随着NO的体积增加,______影响铜丝与硝酸的继续反应.
(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在图中补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来.为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达______,设定有条件精确称量,还需要的数据是______.
(5)计算知:将等体积NO和O2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考.已知氢氧化钠溶液可以吸收NO2,方程式为2NaOH+2NO2═NaNO2+NaNO3+H2O,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为2NaOH+NO2+NO═2NaNO2+H2,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释:
-
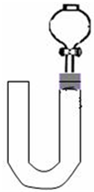
某化学兴趣小组的同学通过实验比较等体积(200mL)0.55mol/L硫酸、1.1mol/L盐酸、1.1mol/L醋酸分别与过量金属反应生成氢气的速率请你协助完成如下实验,并回答相关问题.
(1)实验用品:仪器(略)、药品(除给定的三种酸溶液外,在Na、Mg、Fe三种金属中选择最合适的一种,并说明理由).选择的金属是________,不选其它两种金属的理由是________.
(2)实验原理:(用离子方程式表示)________.
(3)甲同学设计的实验装置,乙同学认为该装置不能控制三个反应在同一时间发生,并作了相应的改进.你认为乙同学改进的措施是:________.
(4)按改进后的装置进行实验,实验中HCl与金属反应产生H2质量随时间变化的关系见图一,计算实验在80-120s范围内HCl的平均反应速率________(忽略溶液体积变化,写出计算过程).
(5)请在答题卡的框图中,画出HAc、H2SO4与金属反应产生H2质量随时间变化关系的预期结果示意图.
(6)量筒的规格由________决定.
(7)对盐酸和醋酸反应图象的异同,你的解释是________.
-
I.某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10 mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去,
方案②:B中加入KSCN溶液,溶液不变血红色,再加入新制的氯水,溶液变血红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
(1)上述实验方案中能证明该反应液有Fe2+生成的是_____________。
Ⅱ.氨气具有还原性,在加热时与氧化铜发生反应的化学方程式为:2NH3+3CuO N2+3Cu+3H2O
N2+3Cu+3H2O
某化学实验小组拟用下列仪器(可重复使用)证明氨气具有还原性,并检验生成的水。现提供浓氨水、氧化铜,若需其他试剂可自选。(连接和固定仪器用的胶管、铁夹、铁架台等装置均略去),请回答下列问题:
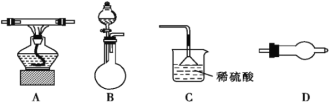
(2)上述仪器从左到右的连接顺序是__→D→__→D→__(填字母)。____________
(3)烧瓶中加入的固体试剂可以是___。
①生石灰 ②五氧化二磷 ③硫酸铜 ④氢氧化钠
(4)装置C中倒扣漏斗的作用是__________________。
(5)需重复使用的仪器D中所选用的固体药品依次是_____。
(6)实验中证明有水生成的现象是_______________________________
-
(9分)为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:
【方案I】
(1)组装发生并测定生成气体体积的实验装置,并检验气密性;
(2)称取碳酸钙样品W g;
(3)加入过量盐酸;
(4)收集并测定生成的气体体积V mL。
问题I—1:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸
钙的纯度会________(填“偏高、偏低、无影响”)。
问题I—2:在方框中画出测定生成的气体体积的装置简图。

【方案II】
(1)称取碳酸钙样品Wg;
(2)在锥形瓶中用C mol/L盐酸V mL(过量)溶解样品;
(3)加入甲基橙作指示剂,再用浓度为C1 mol/L的标准氢氧化钠溶液滴定过量的盐酸,用去氢氧化钠溶液V1毫升。(已知甲基橙的变色范围是pH=3.1~4.4)
问题II—1:未滤去不溶物SiO2,对测定结果是否有影响?(填有或无)________;
理由是________。
问题II—2:碳酸钙纯度表达式________。
【方案评价】
你认为以上两个方案中,最好的方案是,
另一个方案不够好的理由是________。
 实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。 H++B2-








