-
.某化学兴趣小组测定某FeCl3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。

请根据上面叙述,回答:
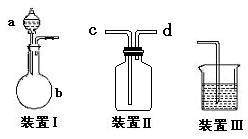
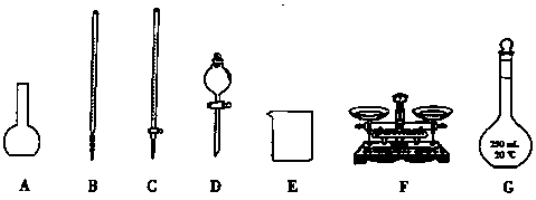
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E和________(填字母)。
(2)写出步骤④中发生反应的离子方程式________。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
Fe2+ + ClO3— + ________= Fe3+ + Cl— + H2O
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成 (填偏大、偏小或不影响),
(4)若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为________。(列出算式,不需化简)
-
(15分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
①称量a g样品,置于烧杯中;
②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全;
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤、洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
请根据上面叙述,回答:
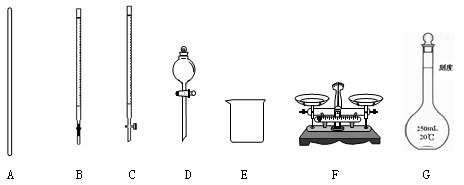
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。
(2)写出步骤③中发生反应的离子方程式 。
(3)洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作是 。
(4)如何确定沉淀是否洗涤干净的操作是 。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为 。(列出算式,不需化简)
(6)该兴趣小组中甲学生认为:实验步骤③中不加入氯水,其余步骤不变,仍可达到实验目的。你认为甲学生的观点是否正确? (填正确或错误);请说明理由: 。
-
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
①称量a g样品,置于烧杯中;
②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全;
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦…
请根据上面叙述,回答:
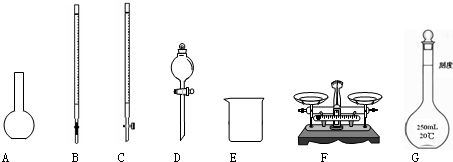
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E和______(填字母).
(2)写出步骤③中发生反应的离子方程式______.
(3)洗涤是洗去附着在沉淀上的______(写离子符号),洗涤沉淀的操作是______.
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g;再次加热并冷却室温称量其质量为m2g,且m1-m2=0.3,接下来的操作应当是______.
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为______.(列出算式,不需化简)
(6)该兴趣小组中甲学生认为:实验步骤③中不加入氯水,其余步骤不变,仍可达到实验目的.你认为甲学生的观点是否正确?______(填正确或错误);请说明理由:______.
-
(14分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称取a g样品,置于烧杯中;
② 加适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
 ⑦……。
⑦……。
请根据上面叙述,回答:
(1)上图仪器中,实验步骤①②③中必须用到的仪器是E和________
(填仪器序号)
(2)写出步骤③中发生反应的离子方程式
(3)步骤④中如何证明沉淀已完全?________
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是________
(5)若坩埚质量是W1 g,最终坩埚和固体的总质量是W2 g,则样品中铁元素的质量分数为________________________。
-
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
①称量a g样品,置于烧杯中;
②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦重复以上操作,至最后两次称得的质量不超过0.1g为止.
请根据上面叙述,回答:
(1)如图所示仪器中,本实验步骤①②③中必须用到的仪器是E、F和______(填字母).
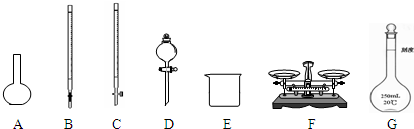
(2)步骤②加入盐酸的目的是______;加快样品溶解的最简单操作是______.
(3)写出步骤③中发生反应的离子方程式______.
(4)步骤⑤的洗涤是洗去附着在沉淀上的______(写离子符号),洗涤沉淀的操作______.
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为______.
-
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过0.1g为止。
请根据上面叙述,回答:
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E、F和________(填字母)。
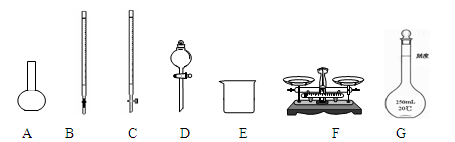
(2)步骤②加入盐酸的目的是________;加快样品溶解的最简单操作是________。
(3)写出步骤③中发生反应的离子方程式________。
(4)步骤⑤的洗涤是洗去附着在沉淀上的________(写离子符号),洗涤沉淀的操作________。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为________。
-
(10分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称取a g样品,置于烧杯中;
② 加适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
请根据上面叙述,回答:
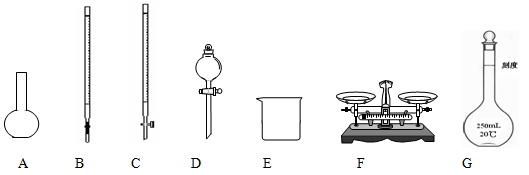
(1)上图仪器中,实验步骤①②③中必须用到的仪器是E和 (填仪器序号)
(2)写出步骤③中发生反应的离子方程式
(3)洗涤沉淀的操作是
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是
(5)若坩埚质量是W1 g,最终坩埚和固体的总质量是W2 g,则样品中铁元素的质量分数为
-
某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取a g样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.0 mL溶液;
③量取25.0 mL步骤②中配得的溶液,置于烧杯中,加入适量氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑥……
请根据上面叙述,回答:
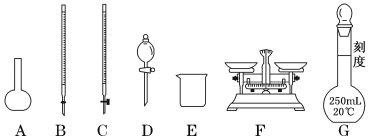
(1)上图所示仪器中,步骤①②③中必须用到的仪器有E和___________(填字母)。
(2)步骤②中:配制50 mL 1.0 mol/L稀H2SO4,需要用量筒量取98%(密度1.84 g/cm3)的浓H2SO4体积为________ mL。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
____Fe2++ ClO2+ === Fe3++ Cl-+ H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果的影响是__________(填“偏大”“偏小”或“不影响”),等物质的量ClO2与Cl2的氧化效率之比为__________。
(4)若步骤⑤不在干燥器中冷却,则测定的铁元素的质量分数会________(填“偏大”“偏小”或“不影响”)。
-
(15分)
某化学研究小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,在实验室中按以下步骤进行实验:
①称取a g样品,置于烧杯中;
②取适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色,冷却至室温后,称量;
⑦……
请根据上面的叙述回答下列问题:
(1)装置D的名称是 ,上图所给仪器中,实验步骤①②③中必须用到的仪器是E和_______ (填仪器序号)。
(2)步骤③中所发生反应的离子方程式为 ,
(3)步骤④中检验沉淀是否完全的操作是
步骤⑤中洗涤沉淀的操作是:________________________________
(4)检验沉淀是否洗净的操作是取最后一次洗涤液,加入几滴______ (填写序号)。
①KSCN溶液 ②NaOH溶液 ③AgNO3溶液 ④酚酞试液
(5)若坩埚质量是W1 g,最终坩埚和固体的总质量是W2 g,则样品中铁元素的质量分数为_______。
-
(16分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:(H-1 O-16 Fe-56)
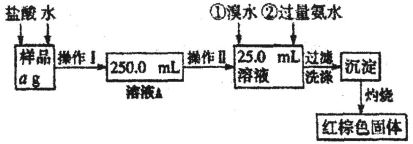
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须有_______、_____(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式____________________________。
(3)检验沉淀是否已经洗涤干净的操作是_____________________________。
(4)该实验中可以回收利用的物质是________________________________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是___ (列出原始计算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是_____(写出一种原因即可)。
(6)为进一步探究样品的性质,他们又利用溶液A做了如下一些实验,其中现象、结论均正确的_
______________(填写序号)。
A.向氢氧化镁悬浊液中滴加A溶液出现红褐色沉淀,证明
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色由黄色变成浅绿色
C.向沸水中滴加A的饱和溶液,立即出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到Fe2O3固体




 ⑦……。
⑦……。




