-
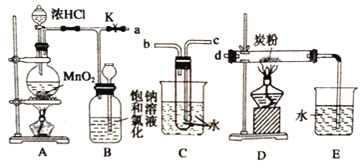
某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰 (MnO2)和石英 (SiO2) 。为了制取氯气并进行氯气的性质实验,其装置如图所示,请回答下列问题:
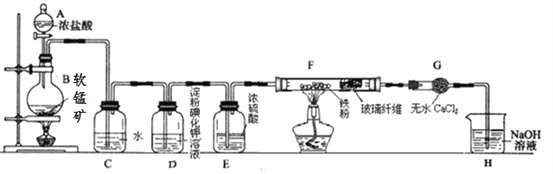
(1)取适量软锰矿置于烧瓶中,加入足量浓盐酸并加热,烧瓶中发生的化学反应为:MnO2 +4HCl(浓) MnCl2+Cl2↑+2H2O。充分反应后烧瓶中残留的固体是____________;若有4mol浓盐酸参与反应,产生的氯气在标准状况下的体积为____22.4L (填“等于”、“小于”或“大于”),浓盐酸在该反应中表现出来的性质_______________________;
MnCl2+Cl2↑+2H2O。充分反应后烧瓶中残留的固体是____________;若有4mol浓盐酸参与反应,产生的氯气在标准状况下的体积为____22.4L (填“等于”、“小于”或“大于”),浓盐酸在该反应中表现出来的性质_______________________;
(2)若将干燥的有色布条放入 C中,观察到的现象是 ______ ,原因是 ______________ (用化学方程式和文字回答);
(3)实验中观察到 D溶液变蓝色,写出 D装置中发生反应的离子方程式 ____________ ;
(4)为探究氯气与 Fe反应的产物与氯气通入量的关系,设计实验,并记录现象如下:
| 实验方法 | 实验现象 | 实验结论 |
| 1.取反应初始阶段(氯气不足量)F中产物,用磁铁除去过量的Fe,剩余产物溶于水中,取上层溶液装入两只试管中,①加入KSCN溶液,②加入KMnO4溶液 | ①KSCN溶液显红色 ②KMnO4溶液不褪色 | (不填) |
| 2.取充分反应后(氯气通入足够长时间)F中产物,溶于水中,加入KMnO4溶液 | KMnO4溶液不褪色 |
根据实验现象,得出实验结论,写出氯气与 Fe粉共热时发生反应的化学方程式______;
(5)已知F中的产物易潮解,在 F和 H装置之间安装 G装置,目的是_________________。
-
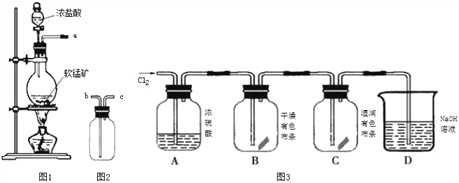
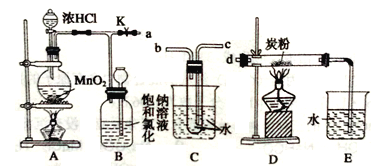
某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰( MnO2)和石英(SiO2)。为了制取Cl2和探究氯及其化合物的相关性质,进行如下实验。
【查阅资料】MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
【制取气体】
(1)取适量矿样置于烧瓶中,加入足量浓盐酸并加热,充分反应后烧瓶中残留的固体是____。
(2)收集氯气应将图1导管的a接口与图2导管的_____________接口连接(填“b”或“c)。
(3)已知氯气中含有HCl杂质,可用______________除去。
【实验探究】
(4)把红热的铁丝伸入盛有氯气的集气瓶中,铁丝燃烧产生棕褐色的烟。反应的化学方程式是_______________________________________________________________________。
(5)按图3进行实验,观察到B中的有色布条不褪色,C中的有色布条褪色。由此得出的结论是_____________________________________________________________________。
(6)写出C中反应的化学方程式:_________________________________________________。
【联系实际】
(7)某氯碱工厂的氯气管道发生泄漏,以下采取的措施正确的是______________ (双项选择,填序号)。
A.将人群向高处疏散
B.将人群向低处疏散
C.关闭氯气管道,用碱液浸泡过的棉布覆盖泄漏部位
D.关闭氯气管道,用饱和NaCl溶液浸泡过的棉布覆盖泄漏部位
-
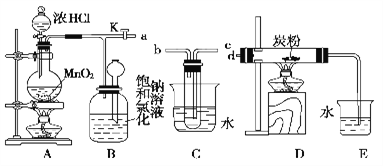
某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2)。为了制取Cl2和探究氯及其化合物的相关性质,进行如下实验。
【查阅资料】MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
【制取气体】
(1)取适量矿样置于烧瓶中,加入足量浓盐酸并加热,充分反应后,烧瓶中残留的固体是 。
(2)收集氯气应将图1导管的a接口与图2的导管的 接口连接(填“b”或“c”)
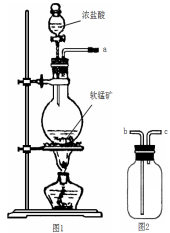
(3)若生成标准状况下11.2LCl2,则参加反应的MnO2的质量为 g。
【实验探究】
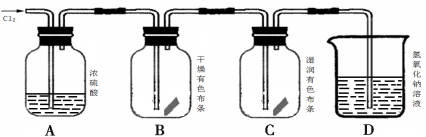
(4)把红热的铁丝伸入盛有氯气的集气瓶中,铁丝燃烧产生棕褐色的烟。反应的化学方程式是
(5)按图3进行实验,观察到B中的有色布条不退色,C中的有色布条退色。由此得出的结论是:
(6)写出D中反应的化学方程式: 。
【知识拓展】
(7)某同学查阅资料得知:高锰酸钾与浓盐酸在常温正好生反应也可以生成氯气(反应的化学方程式为:2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O),该反应的氧化剂是 。.
-
瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先制得了氯气。如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。

(1)A中制取Cl2反应的化学方程式是_________。
(2)要将C装置接入B和D之间,正确的接法是a→________→_____________→d。
(3)实验开始先点燃A处的酒精灯,打开夹子K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是_________。
-
瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先制得了氯气。如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
(1)A中圆底烧瓶内发生反应的离子方程式:_____________________________________。
(2)要将C装置接入B和D之间,正确的接法是a→_____→_____→d。
(3)实验开始先点燃A处的酒精灯,打开夹子K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为________________________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是___________________________________。
(4)D处反应完毕后,关闭夹子K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是___________。
-
I、瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先制得了氯气。如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
(1)A中盛放浓盐酸的仪器的名称是______________。
(2)要将C装置接入B和D之间,正确的接法是a→_____→_____→d。
(3)实验开始先点燃A处的酒精灯,打开夹子K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为__________________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是__________________。
(4)D处反应完毕后,关闭夹子K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是___________。
II、某学生设计如下实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
(1)漂白粉将在U型管中产生,其化学反应方程式是___________。
(2)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现主要原因是在U型管中存在两个副反应:
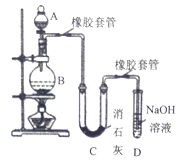
①温度较高时氯气与消石灰反应生成了Ca(C1O3)2,为避免此副反应的发生,可采取的措施是___________________。
②试判断另一个副反应是(写出此反应方程式)____________,为避免此副反应发生,可采取的措施是_____________。
-
瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先制得了氯气。如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
(1)A中盛放浓盐酸的仪器的名称是______________。
(2)要将C装置接入B和D之间,正确的接法是a→_____→_____→d。
(3)实验开始先点燃A处的酒精灯,打开夹子K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为__________________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是__________________。
(4)D处反应完毕后,关闭夹子K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,装置B的作用是___________。
-
(15分)瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色有刺激性气味的气体──氯气。某实验小组的同学运用这一原理设计如图所示的实验装置制取干燥的氯气,并通过实验研究氯气的性质。
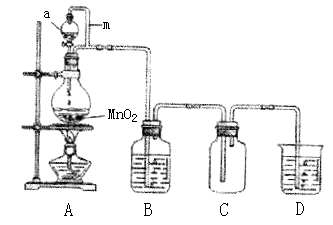
(1)仪器a的名称是________,B中盛放的试剂是________,D中盛放的试剂是________。
(2)向集满氯气的矿泉水瓶C中加入少量水,振荡后瓶子变瘪,溶液变成浅黄色,由此可得出的结论是:________。
(3)取少量(2)中所得溶液滴入到紫色石蕊溶液中,溶液先变为红色后又褪色。甲同学认为氯气与水发生了化学反应,生成物中有盐酸,验证有Cl-所需要的试剂是________。
乙同学认为氯气与水发生化学反应还有一种产物Q、盐酸、Cl2和Q三种物质均可使石蕊溶液褪色,他选用下列实验用品进行实验探究,请将实验报告填写完整。
实验用品:①石蕊溶液②蓝石蕊试纸③盛有盐酸的试管④盛有氯水的试管⑤充有干燥氯气的试管
| 用品(填序号) | 现象 | 结论 |
| 实验1 | ①③ | 溶液呈红色 | |
| 实验2 | | | Cl2没有漂白性 |
| 实验3 | | | Q具有漂白性 |
-
为了探究和验证氯气的性质,某研究性学习小组以MnO2和浓盐酸为主要原料,设计了如图所示装置(其中a是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞)进行了研究。
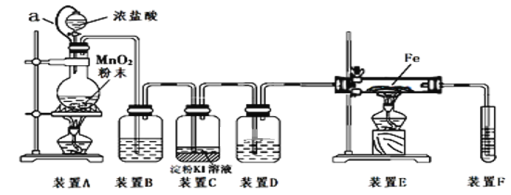
(资料:氯气与铁反应制取氯化铁要在无水条件下进行)
试回答下列问题:
(l)装置A中发生反应的化学方程式为_____________________。
(2)装置B中的试剂为_________,装置D作用是________。
(3)装置C中发生反应的离子方程式为_____________________________。
(4)反应开始后,装置E发生反应的化学方程式为____________________________。
(5)装置F中发生反应的化学方程式为________________________。
-
早在1774年,瑞典化学家舍勒在研究软锰矿(主要成分 )的过程中,将它与浓盐酸混合加热,产生了黄绿色气体—氯气。某小组同学利用舍勒发现氯气的方法制取氯气并探究其性质。
)的过程中,将它与浓盐酸混合加热,产生了黄绿色气体—氯气。某小组同学利用舍勒发现氯气的方法制取氯气并探究其性质。
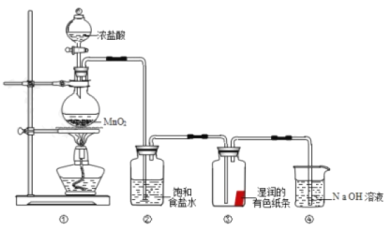
请回答:
(1)装置①中制取氯气,盛有浓盐酸的玻璃仪器名称为__________
(2)装置②的作用是________________________________________.
(3)装置③中的现象是________________________________________.
(4)装置④中反应的离子方程式是________________________________________.
MnCl2+Cl2↑+2H2O











