-
铜是一种常见的金属,在生活、生产中有广泛的应用。
(1)电气工业上常用铜作电缆的内芯,是利用铜具有良好的 性;
(2)铜是一种不活泼的金属,但铜制品长期露置在潮湿空气中,表面变绿色,即生成了“铜绿”[化学式:Cux(OH)yCO3]。
小明和小丽为了探究“铜绿”的组成,查阅资料:“铜绿”受热易分解生成CuO、CO2和H2O。他们进行如下实验:称取22.2克“铜绿”,充分加热至固体质量不再改变,把产生的气体全部依次通过足量浓硫酸和足量氢氧化钠的溶液,发现浓硫酸增重1.8克,氢氧化钠溶液增重4.4克。
根据以上实验,他们推断出:x= ,y= ;
铜与潮湿空气中变成“铜绿”的化学方程式是 ;
(3)小明和小丽分别取24.0克氧化铜,用CO还原制铜,小明得到19.2克红色固体,小丽得到20.8克红色固体。他们质疑:为什么两人得到的红色固体质量不相等?
查阅资料:
Ⅰ.CO还原CuO时也可产生红色的氧化亚铜(Cu2O)
Ⅱ.Cu2O+H2SO4(稀)═Cu+CuSO4+H2O
他们分析推断:
①一致认为 (填“小明”或“小丽”)的产物中没有Cu2O;
②用CO还原a克Cuo得到红色固体b克,若红色固体为Cu和Cu2O的混合物,则a与b的数量关系是 ;
③还可以简单的实验验证红色固体是否有Cu2O,请简述操作、现象及结论:
。
九年级化学填空题中等难度题查看答案及解析
-
金属材料在生产、生活中应用广泛。
(1)由于金属铜具有良好的________,常用于制作导线。
(2)铁制品锈蚀的过程,实际上是铁与________等发生化学反应的过程。工业上常用稀盐酸除去铁制品表面的锈,该反应的化学方程式是________。
(3)某工厂排放的废液中含有硫酸亚铁和硫酸。取一定量的废液样品,加入过量的铁粉,充分反应后其中的溶质是________;反应后所得溶液的质量与反应前相比________。(选填“增大”、“减小”或“无法判断”)。
九年级化学简答题中等难度题查看答案及解析
-
(2011•建邺区一模)金属材料在生产、生活中有着广泛的应用.
(1)下列生活用品,主要利用金属具有良好导热性的是:______.
(2)工业生产中,切割铁板时用硫酸铜溶液在铁板上画线可留下红色的印迹.有关反应的化学方程式为______.
(3)若要比较铁、锰、铜的金属活动性强弱,可选择的药品除了铁、铜单质外,还需要______.
(4)研究性学习小组为了测定黄铜(铜、锌合金)的组成,用电子天平分别称得锥形瓶与棉花的质量为44.1g,称取黄铜样品20.0g.在锥形瓶中加入该样品和足量稀硫酸后瓶口塞上棉花,如图1所示.将电子天平称量的数据绘成图2.
请认真分析数据,回答下列问题:
(Ⅰ)四个同学从多角度处理数据,下列数据处理的图象中正确的是______.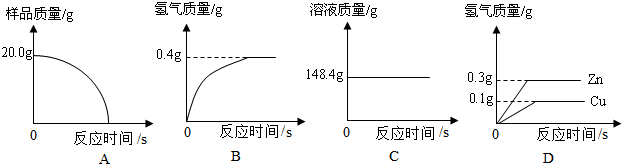
(Ⅱ)试计算:①样品中铜的质量分数;②恰好反应时所得溶液中溶质的质量分数.九年级化学解答题中等难度题查看答案及解析
-
铜是生活中常见的一种金属,在生活、生产中有广泛的应用。
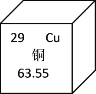
(1)如图为铜元素在元素周期表中的信息,铜元素的原子序数为___;
(2)铜离子(Cu2+)的核外电子数为____________;
(3)电气工业上常用铜作电缆的内芯,是利用铜具有良好的_____性;
(4)铜是一种不活泼的金属,但铜制品长期露置在潮湿空气中,表面变绿色,即生成了“铜绿”(化学式:Cu2(OH)2CO3)。
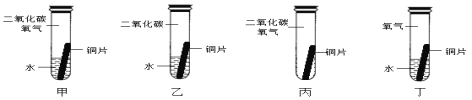
某同学根据铜绿的成分Cu2(OH)2CO3作出猜想:金属铜锈蚀的条件除有氧气和水外,还必须有二氧化碳。为证明“必须有二氧化碳”,需要进行如图所示实验中的_____(选填实验编号甲、乙、丙、丁)
(5)某兴趣小组以锈蚀严重的废铜屑为原料(假设不含其他杂质)制取纯铜。如图是兴趣小组设计的两种回收铜的实验方案:
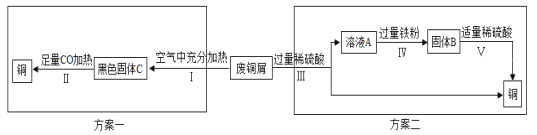
查阅资料:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑
(分析评价)
①步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是___________;
②步骤Ⅳ过程发生反应的化学方程式为__________________、_________________;
③同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一_____(填“>”或“=”或“<”)方案二。以上两种方案中,方案二优越于方案一,理由是________(答一点)。
(拓展探究)在方案一中,小明和小丽分别取24克氧化铜,用CO还原,小明得到19.2克红色固体,小丽得到20.8克红色固体。为什么两人得到的红色固体质量不相等?
查阅资料:
Ⅰ.CO还原CuO时也可产生红色的氧化亚铜(Cu2O)
Ⅱ.Cu2O+H2SO4(稀)=Cu+CuSO4+H2O
他们分析推断:
④一致认为________(填“小明”或“小丽”)的产物中肯定含有Cu2O;
⑤用CO还原4克CuO得到红色固体a克,若红色固体为Cu和Cu2O的混合物,则a的取值范围为____________;
⑥可以用简单的实验验证红色固体中是否有Cu2O,请简述操作、现象及结论:_____。
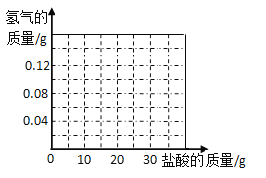
(6)我国约在南北朝时就开始冶炼黄铜。黄铜是铜和锌的合金(Cu-Zn),它可用来制造电器零件及日用品。为了测定某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),现将30g稀盐酸分三次加入到10g黄铜样品粉末中,每次充分反应后,测定本次生成氢气的质量,实验数据见表。试求:
第一次
第二次
第三次
加入稀盐酸的质量(g)
10
10
10
本次生成氢气的质量(g)
0.04
m
0.02
①m=____________。
②此黄铜样品中铜的质量分数是多少_______?。
③稀盐酸的溶质质量分数是_______。
④在坐标系中画出生成氢气总质量与加入盐酸质量关系的图像。______
九年级化学综合题困难题查看答案及解析
-
铁和铜在生产、生活中应用广泛。
(1)电路中经常用铜作导线,这是利用其良好的______性。
(2)建造港珠澳大桥需要大量的钢铁,工业上可用一氧化碳和赤铁矿石(主要成分是氧化铁)反应来炼铁,其反应的化学方程式为______。
(3)港珠澳大桥钢管桩涂上高性能涂层可防止生锈,其原理是______。
(4)某工厂将生产过程中产生的含铜废料进行回收并合理应用:
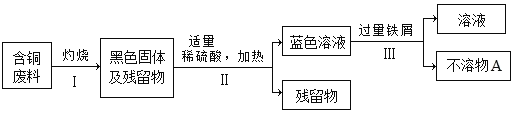
①将步骤Ⅱ反应的化学方程式补充完整:______+H2SO4
CuSO4+H2O
②古代“湿法冶金”的原理与图中步骤______(填“Ⅰ”、“Ⅱ”或“Ⅲ”)的反应原理相同。
③利用化学方法从“不溶物A”中提纯铜单质:______(用化学方程式表示)。
九年级化学流程题简单题查看答案及解析
-
人类的生活和生产都离不开金属,铝、铁、铜是人类广泛使用的三种金属,与我们的生活息息相关。
(1)生活中常用铜做导线,主要是利用了铜的 。
(2)铝制品具有良好抗腐蚀性能的原因是 。
(3)为了验证三种金属的活动性顺序,可选择Al、Cu和下列试剂中的 来达到实验目的。(选填字母序号)
A.Al2(SO4)3溶液 B.FeSO4溶液 C.CuSO4溶液
(4) 请你写出一条保护金属资源的有效途径 。
九年级化学填空题中等难度题查看答案及解析
-
铁在生产生活中应用十分广泛.
(1)工业上常用赤铁矿(主要成分是Fe2O3)和一氧化碳在高温下炼铁,其反应的化学方程式为________.
(2)下列铁制品在使用时,主要利用金属具有良好导热性的是________ (填标号).
A.铁锤 B.铁丝 C.铁锅
(3)如图实验中,洁净无锈的铁钉在________ (填标号)情况下最容易生锈.写出防止铁制品生锈的l条措施:________
(4)某麦片里添加了一种极细的铁粉,食用后在胃酸(含HCl)作用下可被人体吸收.写出铁与胃酸反应的化学方程式:________.
九年级化学填空题中等难度题查看答案及解析
-
人类的生活和生产都离不开金属,铝、铁、铜是人类广泛使用的三种金属,与我们的生活息息相关。
(1)生活中常用铜做导线,主要是利用了铜的_____。
(2)铝制品具有良好抗腐蚀性能的原因是_____。
(3)农业上用硫酸铜、生石灰加水配制波尔多液作为杀菌剂。有经验的农民都不用铁质容器来配制或盛放波尔多液,原因是_____(用化学方程式表示)。
(4)钢铁车身喷漆处理既美观又防锈,喷漆防锈的原理是_____。
九年级化学简答题中等难度题查看答案及解析
-
(7分)金属铁、铝、铜在生产和生活中有广泛的应用。
(1)地壳中含量最多的金属元素是 。
(2)金属铜做导线是利用其延展性和 性。
(3)铁是应用最广泛的金属。工业常用赤铁矿(主要成分Fe2O3)和一氧化碳在高温条件下炼铁,该反应的化学方程式为_ 。
(4)实验室中用如下实验来研究铁、铝、铜三种金属活动顺序及其在活动顺序表中相对氢的位置。
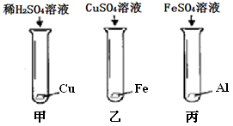
①乙实验的现象为_______________________________________________
②若将上述实验之一替换掉一种药品,即可达成实验目的。说明具体的改进方法:________________________________________________
③按如图实验结束后,将乙、丙实验后的剩余物倾倒至一个烧杯中,充分反应。然后将甲实验的剩余物倒入此烧杯,无气泡产生。以下说法正确的是________(填序号) 。
A. 最后烧杯中的溶液不可能是无色的
B. 乙实验中,CuSO4溶液一定是过量的
C. 乙、丙混合过程中,可能没有发生化学反应
D. 最后烧杯中的溶液,一定含有Al2(SO4)3,可能含有FeSO4
九年级化学探究题极难题查看答案及解析
-
铝在工业和生活中应用广泛。
(1)铝是地壳中含量最高的 (填“金属”或“非金属”)元素,其年产量已跃居第二位。
(2)铝可制成电线,主要是利用其有良好的延展性和 性。
(3)铝制品具有很好的抗腐蚀性能,其原因是 。
九年级化学填空题中等难度题查看答案及解析