-
实验室利用二氧化锰和浓盐酸反应制取Cl2,化学方程式如下:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)请用单线桥标出该反应电子转移的方向和数目__,该反应的氧化产物是__。
(2)其中氧化剂与还原剂的物质的量之比是__;若实验中有87g的MnO2完全反应,则制得的Cl2在标况下的体积是__L。
-
实验室利用二氧化锰和浓盐酸反应制取Cl2,化学方程式如下:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)请用单线桥标出该反应电子转移的方向和数目__,该反应的氧化产物是__。
(2)其中氧化剂与还原剂的物质的量之比是__;若实验中有87g的MnO2完全反应,则制得的Cl2在标况下的体积是__L。
-
Ⅰ.实验室利用二氧化锰和浓盐酸反应制取Cl2,化学方程式如下: MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)请用单线桥标出该反应电子转移的方向和数目___________,该反应的氧化产物是___________。
(2)其中氧化剂与还原剂的物质的量之比是___________;若实验中有87g的MnO2完全反应,则制得的Cl2在标况下的体积是___________L。
Ⅱ.盐酸广泛应用在稀有金属的湿法冶金、漂染工业、金属加工、无机药品及有机药物的生产等领域中。HCl极易溶于水,工业上用HCl气体溶于水的方法制取盐酸。
(1)用密度为1.2 g/mL,质量分数为36.5%的浓盐酸配制250mL 3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为________mL。
(2)溶液配制中需要的玻璃仪器有烧杯、玻璃棒、量筒、___________、___________。
(3)实验过程中,下列操作会导致最终所配溶液浓度偏高的是____________。
A.量取浓盐酸时俯视刻度线 B.实验前,容量瓶中有少量残留蒸馏水
C.定容时俯视刻度线 D.转移时,未洗涤烧杯和玻璃棒
-
实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式如下:
MnO2+4HCl=MnCl2+Cl2↑+2H2O
(1)该反应属于氧化还原吗?如果是,指出其中的氧化剂和还原剂;如果不是,说明理由。
(2)密度为1.19g·cm-3、溶质的质量分数为36.5%的浓盐酸200mL,跟足量二氧化锰发生反应,产生的氯气在标准状况下的体积为11.2L。计算参加反应的浓盐酸的体积以及反应中被氧化的HCl的物质的量。
-
Ⅰ.实验室可以用二氧化锰和浓盐酸反应制取氯气,方程式如下:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,下图是某学生设计的试验室制备干燥Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题:
MnCl2+Cl2↑+2H2O,下图是某学生设计的试验室制备干燥Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题:
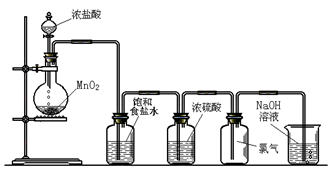
(1)该实验中还缺少一种仪器,这种仪器是_____________;
(2)饱和食盐水的作用是____________________;
(3)氯气与冷的氢氧化钠溶液反应生成NaCl、NaClO和H2O,与热的氢氧化钠溶液按照下面的反应进行:____________________
Cl2+ NaOH(热) - NaCl+ NaClO3+ H2O,请配平上述反应方程式;
(4)8.7 g MnO2和足量的浓盐酸反应,其中被氧化的HCl的物质的量为_________mol。
Ⅱ.某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验。

(1)B是用来收集实验中生成的气体的装置,但未将导管画全,请把导管补充完整_____________;
(2)D中的现象是_____________________;
(3)E中NaOH溶液的作用是_________________;
(4)下列药品中能够用来验证反应停止后的烧瓶中有H2SO4剩余的是__________(填字母编号)。
a.BaCl2溶液 b.NaHCO3粉末 c.Ba(NO3)2溶液 d.银粉
-
实验室常用浓盐酸和二氧化锰反应来制取少量氯气,反应的化学方程式为:
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O。
MnCl2 + Cl2↑ + 2H2O。
取8.7g的MnO2与50mL足量的浓盐酸发生反应制取氯气。求:
(1)生成的还原产物的物质的量是多少?
(2)(忽略Cl2的溶解)产生的氯气在标准状况下的体积为多少?
(3)反应中被氧化的HCl的物质的量是多少?
-
(7分)实验室常用浓盐酸和二氧化锰反应来制取少量氯气,反应的化学方程式为:MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O。取8.7g的MnO2与50mL足量的浓盐酸发生反应制取氯气。求:
MnCl2 + Cl2↑ + 2H2O。取8.7g的MnO2与50mL足量的浓盐酸发生反应制取氯气。求:
①(忽略Cl2的溶解)产生的氯气在标准状况下的体积为_________,参加反应的HCl有______mol。(4分)
②若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度 。(3分)
-
实验室常见浓盐酸和二氧化锰反应来制取少量氯气,反应的化学方程式为:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O.8.7g的MnO2与50mL足量的浓盐酸发生反应制取氯气.计算:
(1)被氧化的HCl有______mol,转移的电子数为______个.
(2)若向反应后剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度?(要有具体的计算过程)
-
(9分)实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为
MnO2 + 4HCl(浓)  MnCl2 + Cl2↑+ 2H2O。
MnCl2 + Cl2↑+ 2H2O。
(1)该反应的氧化剂是 ,氧化产物是 ,用单线桥法表示上述反应电子转移方向和数目。
(2)计算当有73.0克HCl完全参加反时,消耗MnO2的物质的量为多少?生成的气体在标准状况下的体积多少升?
-
实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)该反应的氧化剂是 ,氧化产物是 ,用双线桥法表示上述反应电子转移方向和数目;
(2)计算当有73.0克HCl被氧化时,消耗MnO2的物质的量为 ;
(3)在反应MnO2+4HCI MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是 。
MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是 。
MnCl2+Cl2↑+2H2O

