-
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,相关微粒的物质的量如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )

A.H2A在水中的电离方程式是:H2A=H++HA-;HA- H++A2-
H++A2-
B.当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
D.当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
-
常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示判断,下列说法正确的是( )
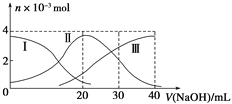
A. H2A在水中的电离方程式是:H2A===H++HA-、HA- H++A2-
H++A2-
B. 等体积等浓度的NaOH溶液与H2A溶液混合后溶液显碱性
C. 当V(NaOH)=20 mL时,溶液中存在以下关系:c(H+)+c(H2A)=c(A2-)+c(OH-)
D. 当V(NaOH)=30 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
-
常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2AⅡ代表HA-Ⅲ代表A2-)根据图示判断下列说法正确的是( )
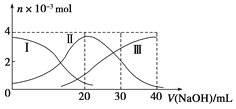
A.H2A在水中的电离方程式是:H2A=H++HA-、HA-⇌H++A2-
B.当V(NaOH)=20mL时溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后其溶液中水的电离程度比纯水大
D.当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
-
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH 溶液。有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)根据图示判断,下列说法正确的是

A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.欲使NaHA溶液呈中性,可以向其中加入酸或碱
D.向NaHA溶液加入水的过程中,pH可能增大也可能减少
-
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,含A元素的有关微粒物质的量变化如下图所示。根据图示判断,下列说法正确的是
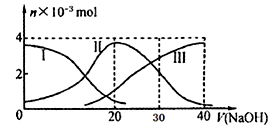
A. H2A在水中的电离方程式是:H2A == H+ +HA- ; HA-  H++A2-
H++A2-
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C. 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+ c(HA-)+ 2c(H2A)=c(A2-)+2c(OH-)
D. 当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(OH-)
-
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,含A元素的有关微粒物质的量变化如下图所示。根据图示判断,下列说法正确的是
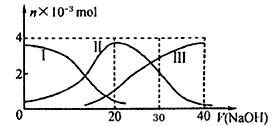
A. H2A在水中的电离方程式是:H2A == H+ +HA- ; HA-  H++A2-
H++A2-
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C. 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+ c(HA-)+ 2c(H2A)=c(A2-)+2c(OH-)
D. 当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(OH-)
-
常温下,向20 mL 0.2 mol/L 二元酸H2A溶液中滴加0.2 mol/L NaOH溶液,有关微粒物质的量变化如右图。下列叙述正确的是
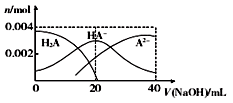
A. 从图象中可知H2A为强酸
B. 当V(NaOH)=20 mL时,溶液中各离子浓度的大小
顺序为c(Na+)>c(HA-)> c(H+) >c( A2-) >c(OH-)
C. 当V(NaOH) =20 mL时混合溶液的pH值大于7
D. 当V(NaOH) =40 mL时,升高温度,c(Na+)/c(A2-)减小
-
常温下,向20 mL 0.2 mol/L 二元酸H2A溶液中滴加0.2 mol/L NaOH溶液,有关微粒物质的量变化如右图。下列叙述正确的是
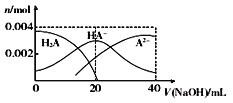
A. 从图象中可知H2A为强酸
B. 当V(NaOH)=20 mL时,溶液中各离子浓度的大小
顺序为c(Na+)>c(HA-)> c(H+) >c( A2-) >c(OH-)
C. 当V(NaOH) =20 mL时混合溶液的pH值大于7
D. 当V(NaOH) =40 mL时,升高温度,c(Na+)/c(A2-)减小
-
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )
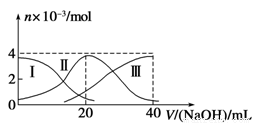
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:
c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
B.等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水小
C.NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A)
D.向上述加入20mLNaOH溶液后所得溶液中再加入水的过程中,pH可能减少
-
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液。有关微粒的物质的量变化如右图,下列说法正确的是
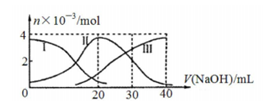
A.滴加过程中当溶液呈中性时,V(NaOH)>20mL
B.当V(NaOH)=30mL时,则有:2c(Na+)=3c(A2-)+3c(HA-)
C.H2A在水中的电离方程式是:H2A=H++HA-;HA- H++A2-
H++A2-
D.当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)

H++A2-








