-
“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究。
探究氰化物的性质:已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 25℃电离平衡常数 | Ki=1.77×10﹣4 | Ki=5.0×10﹣10 | Ki1=4.3×10﹣7 Ki2=5.6×10﹣11 |
(1)NaCN溶液呈碱性的原因是________________________ (用离子方程式表示)
(2)如图表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是_________
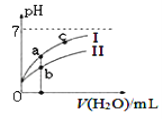
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(CN﹣)>c(HCOO﹣)>c(OH﹣)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:CN﹣+CO2+H2O=HCN+CO32﹣
C.图像中a点酸的总浓度小于b点酸的总浓度
D.c点溶液的导电性比a点溶液的导电性弱
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为_____。
(4)下列四种离子结合H+能力由弱到强的是______________________________________。
A. HCOO- B. CN- C. CO32- D.HCO3-
-
“2015·8·12”天津港爆炸中有一定量的氰化物泄露。氰化物多数易溶于水,有剧毒,易造成水污染。已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(1)根据价键规则,写出H2CO3的结构式__________。
(2)下列能用于判断氮、碳两种元素非金属性强弱的是_________(填序号)
a. 气态氢化物的稳定性强弱 b. 最高价氧化物对应水化物酸性强弱
c. Al2O3+N2+3C=2AlN+3CO d. 比较在周期表中的位置
(3)0.01mol/L的NaCN溶液pH=9,用离子方程式表示呈碱性的原因_______。 请判断该溶液中:c(CN-)__c(OH-)(填“>”、“<”或“=”)
(4)含CN-的污水危害很大,处理该污水时,可在催化剂TiO2作用下用NaClO将CN-氧化成CNO-。CNO-在酸性条件下继续被NaClO氧化生成N2与CO2。某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN-被处理的百分率。
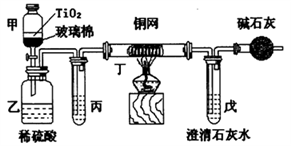
将浓缩后含CN-的废水与过量NaClO溶液的混合液(其中CN-浓度为0.05mol/L)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞。
①甲中反应的离子方程式为___________,乙中反应的离子方程式为________。
②上述实验是通过测定CO2的量来确定CN-的处理效果。若丙中的试剂是饱和食盐水,且丙、丁都是除杂装置,则乙中产生的气体除CO2、N2外,还可能含有的杂质气体是__________,戊中盛有足量的石灰水,若实验后戊中生成0.9g沉淀,则CN-被处理的百分率为_________。
(5)装置中碱石灰的作用是__________。
-
2015年8月12日晚,天津塘沽滨海新区危险品仓库发生大爆炸,造成了巨大损失。 据悉,该危险品仓库存放的危险品有多种,包括剧毒化学品氰化钠(NaCN)。下列有关氰化钠的说法中错误的是()
A. NaCN 中碳元素的化合价为+4
B. NaCN易溶于水,其水溶液呈碱性
C. 可用强氧化剂如H2O2等将NaCN氧化为无毒物质
D. 为防止中毒,须加强对地表水、排海口等的氰化物排查
-
2015年8月12日,天津滨海新区一危险品仓库发生爆炸,其中有一种危险品是氰化钠(NaCN),它遇水后会释放出剧毒物质氰化氢气体.盛装NaCN的罐上应该贴有的危险化学品标识是
A. B.
B. C.
C. D.
D.
-
天津港“8.12”瑞海公司危险品仓库特大火灾爆炸事故,其二次爆炸威力巨大,据推测可能是由于某物质遇水燃烧而引发的连锁反应,下列常见危险品中最有可能具有这种性质的是
A.KN03 B.NH4NO3 C.CaC2 D.P4(白磷)
-
2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢气体。氰化氢的沸点只有26摄氏度,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题
(1)写出氰化钠遇水产生氰化氢的离子方程式 。
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式 。
(3)氰化钠遇到亚硝酸钠能生成两种气体发生爆炸,写出化学反应方程式 。
(4)爆炸残留在废水中的CN- 可以用Cr2O72-处理,拟定下列流程进行废水处理,
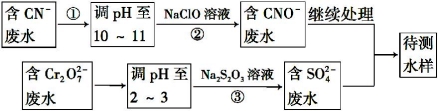
1)上述处理废水流程中主要使用的方法是 ;
A.混凝法 B.中和法 C.沉淀法 D.氧化还原法
2)②中反应后无气体放出,该反应的离子方程式为_______________________;
3)步骤③中,每处理0.4 mol Cr2O72 - 时转移电子2.4 mol,该反应的离子方程式为
-
某石化公司双苯厂发生爆炸事故,造成大量苯、二甲苯、硝基苯等泄漏随消防水流入河流,引起河水污染。下列关于苯、二甲苯、硝基苯的叙述正确的是 ( )
A. 苯、二甲苯、硝基苯都易溶于水而引起河水污染
B. 实验室由苯和浓硝酸、浓硫酸的混合物共热至50℃~60℃发生取代反应生成硝基苯
C. 苯、二甲苯、硝基苯三者的密度都比水小
D. 邻二甲苯的一氯取代物有2种同分异构体
-
化学在生产和生活中有着重要的应用。下列说法正确的是
A. 硫酸钡在医学上用作钡餐,Ba2+对人体无毒
B. PM2.5是指氮、硫的氧化物溶于水形成的酸性液体造成的空气污染
C. “辽宁舰”上用于拦阻索的特种钢缆,属于新型无机非金属材料
D. 明矾[KAl(SO4)2·12H2O]水解时产生具有吸附性的胶体粒子,可作净水剂
-
下列说法中正确的是
A.石油分馏、煤的干馏均是物理变化
B.PM2.5是指氮、硫的氧化物溶于水形成的酸性液体造成的空气污染
C.可利用清洁能源如太阳能、潮汐能、风能来发电
D.铅蓄电池、锂电池、碱性锌锰干电池都属于二次电池
-
天津港“8·12”危化仓库爆炸,造成生命、财产重大损失,下列物质与危险化学品标志的对应关系不正确的是


 B.
B. C.
C. D.
D.

